|
7 Спектр света, испускаемого газосветной трубкой.
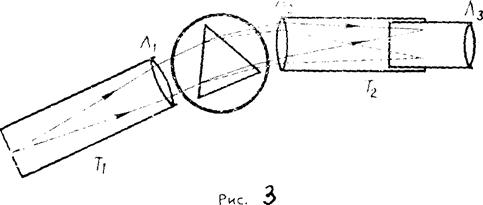
Поместим перед щелью спектроскопа трубку, наполненную водородом при низком давлении. При подключении трубки к источнику высокого напряжения в трубке начинается электрический разряд, и она испускает красноватый свет. Спектр этого света состоит из нескольких светлых линий, разделенных темными промежутками. Такой спектр получил название линейчатого спектра испускания.
8 Спектры поглощения.
Поставив между щелью спектроскопа и лампой накаливания трубку, заполненную водородом, мы на фоне сплошного спектра испускания нити лампы накаливания обнаружим в желтой его части несколько темных(черных) линий. Такие спектры получили название линейчатых спектров поглощения, а сами темные линии получили название линий поглощения. Спектры поглощения впервые наблюдал Г. Кирхгоф.
Линейчатые спектры образуются, если свет испускается или поглощается веществом в газообразном атомарном состоянии.
Было замечено, что положения темных линий в спектре поглощения вещества при данной температуре в точности совпадают с положениями светлых линий в спектре испускания этого же вещества при той же температуре. Иначе говоря, вещество в атомарном газообразном состоянии при данной температуре испускает и поглощает волны одинаковых частот. Это правило обращения спектральных линий, или правило Кирхгофа.
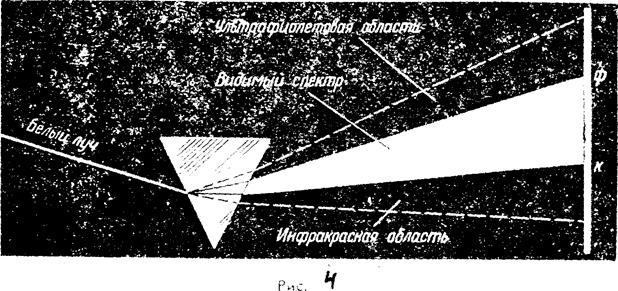

Спектральным анализом называется метод определения химического состава сложных веществ, основанный на изучении линейчатых спектров этих веществ. Состав вещества может быть определен по спектру испускания (эмиссионный метод) или по спектру поглощения (абсорбционный, метод).
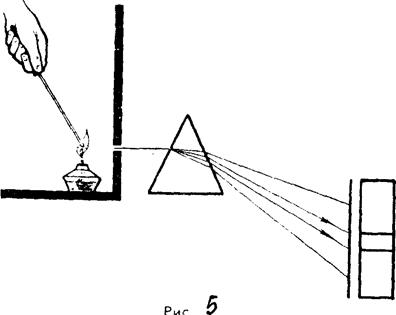
Эмиссионный метод. Если в затемненном помещении перед щелью спектроскопа поставить горящую спиртовку, то мы увидим сплошной спектр очень малой яркости. Источником света, дающим этот сплошной спектр, являются раскаленные твердые частицы в пламени.
Внесем в пламя спиртовки крупинку поваренной соли(NаС1). Мы заметим, что пламя окрасится в интенсивный желтый цвет, а в его спектре появятся две яркие желтые линии, расположенные в желтой части спектра (рис. 5). То же можно наблюдать, если вместо поваренной соли внести в пламя спиртовки крупинку глауберовой соли (Nа2SО4), йодистого натрия (NаI), сульфида натрия (Nа2S) или карбоната натрия(Na2СО3). Любая соль натрия, будучи введена в пламя спиртовки, окрашивает его в желтый цвет, и в желтой части спектра появляются две яркие желтые линии. Иными словами, характерной чертой натрия является то, что его раскаленные пары дают спектр, в котором всегда присутствуют две яркие линии в желтой части спектра.
Если через находящиеся в стеклянной трубке пары натрия пропустить электрический ток, то эти пары будут светиться желтым светом. В спектре этого излучения также будут указанные выше две желтые линии.
В 1860 г. немецкие ученые Г. Кирхгоф и Р. Бунзен, изучая спектры металлов, установили, что каждый металл в парообразном состоянии имеет свой характерный линейный спектр. Введение в пламя горелки любой соли одного итого же металла всегда приводит к появлению одинакового линейчатого спектра испускания. Отдельные липни к спектрах различных элементов могут случайно совпадать, но в целом спектр каждого элемента является его постоянной и строго индивидуальной характеристикой.
Вместе с тем оказалось, что при внесении в пламя смеси солей разных металлов в спектре одновременно появляются все характерные для этих металлов линии. Яркость спектральных линий зависит от концентрации элемента в данной смеси веществ.

Так был открыт новый метод определения химического состава вещества — спектральный анализ.
Обнаружение в спектре исследуемого образца новых, незнакомых линий означало, что в образце присутствуют примеси неизвестных в то время элементов. С помощью спектрального анализа были открыты сначала рубидий и цезий, а затем таллий, индий, галлий. Всего методом спектрального анализа было открыто 24 химических элемента.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.