




РОЛЬ ПЕРОКСИДНЫХ ПРОИЗВОДНЫХ В ОКИСЛИТЕЛЬНОМ ГИДРОЛИЗЕ АЛКОКСИДОВ КРЕМНИЯ, АЛЮМИНИЯ И ТИТАНА
Н. В. Яблокова
УДК 546.287+621.74(3+4)
Рассмотрены физико-химические процессы начальной стадии формирования оксидных покрытий, полученных окислительным гидролизом алкоксидов кремния, алюминия и титана в присутствии добавок пероксида водорода и гидропероксида трет-бутила. На основании вискозиметрических и кинетических исследований показано, что пероксид водорода и гидропероксид трет-бутила вступают в реакцию солъволиза с алкоксидами кремния, алюминия и титана, образуя элементоорганические пероксипроизводные. Последние при низких температурах способствуют реакции олигомеризации алкоксипроиз-водных, а при температурах выше 100'С — сшиванию олигомеров.
Некоторые оксидные покрытия благодаря сочетанию ценных свойств (термостойкость, прочность, устойчивость к окислению, высокие диэлектрические характеристики, прекрасный внешний вид) находят широкое применение в различных отраслях промышленности. Известно, что керамические оксидные покрытия получают, как правило, при температурах выше 1000°С. Однако в последнее время все большее значение приобретают низкотемпературные методы. Распространение в технике получила золь-гельная технология нанесения керамических оксидных покрытий, когда в качестве исходных веществ используют растворимые в воде или спирте алкоксиды или соли металлов [1,2]. Их подвергают гидролизу или разложению, а затем проводят цикл операций, приводящих к образованию золя и геля. Последние могут быть использованы для получения низкотемпературного оксидного покрытия.
Целью работы является исследование механизма влияния пероксидных окислителей на процесс гидролиза ал"коксидов кремния, алюминия и титана.
В качестве объектов исследования были выбраны тетраизопропилоксисилан (*-РгО)481, триизо-пропилоксиалюминий (*-РгО)зА1 и тетра-к-бутоксититан (га-ВиО)4Т1. Композиции в изо-пропиловом спирте включали вышеуказанные алкоголяты в различных соотношениях, воду (0.2 моль/л), катализатор — НС1 (2 • 10~3 моль/л), а также окислители — пероксид водорода (0.05 моль/л) и гидропероксид трет-бутила (0.5 моль/л).
Состав композиций в изопропанолв (Сн2О 0-2, СнС1 2-Ю"3 моль/л)
|
С(/-РгО)481 |
С(|-РгО)дАЬ |
С(л-ВиО)4Т1. |
||||
|
образца |
моль/л |
моль/л |
моль/л |
|||
|
Сн2О2 °'06 |
моль/л |
|||||
|
1 |
0.5 |
- |
- |
|||
|
2 |
- |
0.5 |
- |
|||
|
3 |
- |
- |
0.5 |
|||
|
4 |
0.25 |
- |
0.25 |
|||
|
5 |
- |
0.25 |
0.25 |
|||
|
6 |
0.19 |
0.16 |
0.15 |
|||
|
С*-ВиООН 0.5 |
моль/л |
|||||
|
7 |
0.5 |
- |
||||
|
8 |
- |
0.5 |
||||
|
9 |
- |
- |
0.5 |
|||
|
10 |
0.25 |
- |
0.25 |
|||
|
11 |
- |
0.25 |
0.25 |
|||
|
12 |
0.19 |
0.16 |
0.15 |
|||
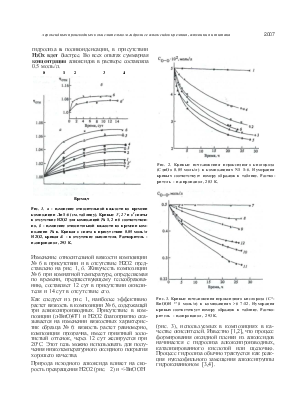
Вискозиметрическим методом изучен процесс отверждения композиций, состав которых представлен в таблице. На рис. 1, а, б показано изменение относительной вязкости во времени образцов № 1—6. Для сравнения на этом же рисунке приведены кривые, полученные для образцов без добавок окислителя (пероксида водорода). Как видно, повышение вязкости образцов, связанное с протеканием реакций
![]() Научно-исследовательский институт химии Нижегородского
государственного университета
Научно-исследовательский институт химии Нижегородского
государственного университета
имени Н. И. Лобачевского
Поступило в Редакцию 22 июня 1994 г.
2006
лероксидных производных в окислительном гидролизе алкоксидов кремния, алюминия и титана
2007
|
|
гидролиза в поликонденсации, в присутствии НзОх вдет быстрее. Во всех опытах суммарная концентрация алкоксидов в растворе составляла 0.5 моль/л.
0 12 3 4
Время, ч
Рис. 1. а - изменение относительной вязкости во времени композиции Ли 1-6 (см. таблицу). Кривые 1', 2? и в1 сняты в отсутствие Н2О2 для композиций № 1, 2 и 6 соответственно, б - изменение относительной вязкости во времени композиции № в. Кривая в снята в присутствии 0.05 моль/л Н2О2, кривая & - в отсутствие окислителя. Растворитель -изопропанол, 293 К.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.