Изменение относительной вязкости композиции № 6 в присутствии и в отсутствие Н2О2 представлено на рис. 1, б. Живучесть композиции № 6 при комнатной температуре, определяемая по времени, предшествующему гелеобразова-нию, составляет 12 сут в присутствии окислителя и 14 сут в отсутствие его.
Как следует из рис. 1, наиболее эффективно растет вязкость в композиции № 6, содержащей три алкоксипроизводных. Присутствие в композиции (л-ВиО)4Т1 и Н2О2 благоприятно сказывается на изменении вязкостных характеристик образца № 6: вязкость растет равномерно, композиция прозрачна, имеет приятный золотистый оттенок, через 12 сут желируется при 20°С. Этот гель можно использовать для получения низкотемпературного оксидного покрытия хорошего качества.
Природа исходного алкоксида влияет на скорость превращения Н2О2 (рис. 2) и <-ВиООН
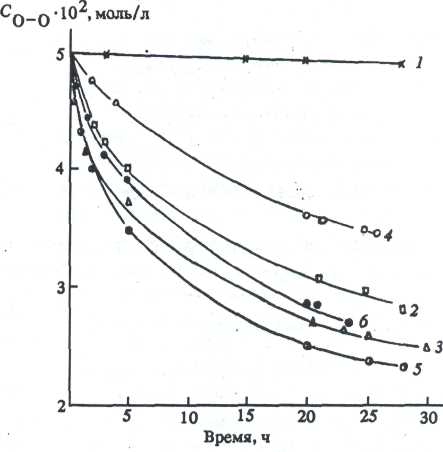
Рис. 2. Кривые исчезновения пероксидного кислорода (СдпОо 0.05 моль/л) в композициях N1 1-6. Нумерация кривых соответствует номеру образцов в таблице. Растворитель - изопропанол, 203 К.
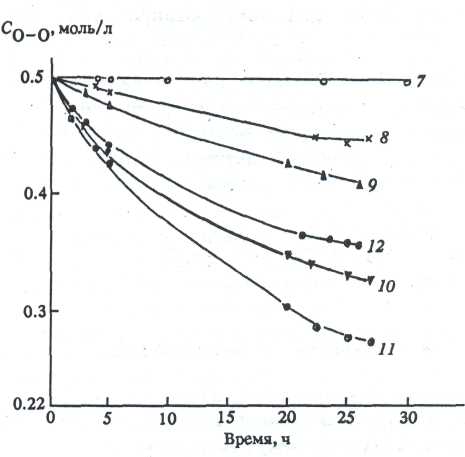
Рис. 3. Кривые исчезновения пероксидного кислорода (С*-ВиООН °'б моль/л) в композициях >6 7-12. Нумерация кривых соответствует номеру образцов в таблице. Растворитель - изопропанол, 293 К.
(рис. 3), используемых в композициях в качестве окислителей. Известно [1,2], что процесс формирования оксидной пленки из алкоксидов начинается с гидролиза алкоксипроизводных, катализированного кислотой или щелочью. Процесс гидролиза обычно трактуется как реакция нуклеофильного замещения алкоксигруппы гидроксианионом [3,4] .
|
|
|
|
|
|
|
|
|
|
|
|
|
стабильных соединений I ■ |
Скорость гидролиза возрастает с увеличением концентрации кислоты и воды. Параллельно идет катализируемая кислотой реакция поли-конденсации
Она приводит к последовательному образованию сначала олигомеров с низкой молекулярной массой: димеров, тримеров, простых циклических структур, а затем высокомолекулярных циклических олигомеров. В начальной стадии этот процесс во времени протекает так, как показано рис. 1, 1', 2', б'.
Введение в систему пероксидов оказывает следующее воздействие на композицию: пероксиды вступают в реакцию сольволиза с алкоксидами элементов и образующимися олигомерными соединениями [4,5] .
Реакции (3—5) обратимы. Следует иметь в виду, что образующиеся элементоорганические пероксиды легко подвергаются гидролизу, давая гидроксипроизводные и исходные пероксиды.
Возможность реализации реакций (3—5) в значительной степени зависит от природы гетеро-элемента Е в исходном алкоксипроизводном. Если Е = 81, то по реакциям (3—5) образуются термически стабильные кремнийорганические пероксиды [6,7] . Они очень медленно разлагаются в композиции (рис. 2, / и 3, 7). Это
Я. В. Яблокова
полифункциональные кремнийорганические пероксиды, которые, как известно [5,8,9], являются хорошими сшивающими агентами для полимерных материалов и промоторами адгезии при связывании оксидных пленок с подложками и наполнителями. Эти свойства кремнийорганические пероксиды проявляют при повышенных температурах (выше 100'С).
Если Е = А1 или "П, то реакции (3) и (5) приводят, вероятно, к образованию промежуточных не-
|
|
|
|
|
|
|
-. Такого типа пе- |
■ II
роксиды в свободном виде не выделены и в литературе не описаны. Быстрое разложение Н2Ог в присутствии (2-РгО)зА1 (рис. 2, 2) или (л-ВиО)4Т1 (рис. 2, 3) можно рассматривать как каталитическое разложение Н2О2, протекающее через промежуточную стадию образования алюминий- и титанорганических перок-сидов и гидропероксидов.
Растворитель — изопропанол — участвует в обменных и окислительно-восстановительных реакциях с участием алкокси- и пероксипроиз-водных. Прежде всего идет количественная обменная реакция бутоксигрупп в (л-ВиО)4Т1 на изопропильные.
Так как концентрация изопропанола ~10 моль/л, реакция сдвинута вправо и в качестве реагента в композиции выступает не (л-ВиО)4Т1, а 0-РгО)4Т1.
Известно [10], что алкоксиды алюминия и титана при комнатной температуре реагируют с гидропероксидом трет -бутила экзотермически.
Элементоорганические пероксиды строения (А1кО)2А1ООС< и (А1кО)3Т1ООС< в литературе известны. Этокси(трет-бутилперокси)произ-водные титана и алюминия выделены в чистом виде и охарактеризованы [11,12] . В инертных растворителях они достаточно стабильны и разлагаются в интервале температур 40—80°С
|
|
|
|
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.