Имеющийся в кольце заместитель не только влияет на реакционную способность, но и проявляет ориентирующее действие по отношению к вводимому в кольцо электрофилу.
Ориентирующее влияние заместителей обусловлено их электронными эффектами (статический фактор). Статический фактор отражает распределение электронной плотности в молекуле субстрата. Например, в толуоле электрондонорная группа повышает электронную плотность на всех атомах углерода кольца, но особенно в орто- и пара- положениях.
|
|
|
|
|
По влиянию статических и динамических факторов на реакционную способность и ориентацию в реакциях электрофильного замещения заместители делятся:
-NH2, - NHR, - NR2, -OH +M>> -I сильно активируют
-OCH3, -OR, -NHCOR +M> -I умеренно активируют
-CH3 +I слабо активируют
- C6H5, -- CH = CH2 +M> -I слабо активируют
- F, -Cl, -Br, -I - I> +M слабо дезактивируют
Если по силе действия +М эффект от группы превосходит –I эффект, то орто- и параориентант обогащает бензольное ядро электронной плотностью. В деформированной π-системе эта плотность у атомов углерода повышается не равномерно, и в орто- и пара-положениях возникает частичный отрицательный заряд, облегчая атаку электрофила в этих положениях.
Вместе с тем среди заместителей 1-го рода есть такие в которых - I > +M. Тогда электронная плотность в ядре понижается, и оно становится менее доступным для атаки электрофилов. Однако в орто- и пара-положениях она понижается незначительно. Поэтому нитрование галогенбензола протекает труднее, чем самого бензола.
- С ≡ N, -CHO, -COR, -COOH, -I, -M умеренно дезактивируют
-COOR, -SO3H
-CF3, CCl3 -I сильно дезактивируют
-NO2 -I, -M сильно дезактивируют
Правила ориентации в дизамещенных аренах. В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители направляют электрофильный реагент в одни и те же положения кольца.
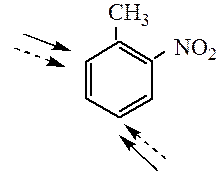
При несогласованной ориентации заместители конкурируют между собой, можно предсказать основное направление реакции, руководствуясь следующими обобщениями:
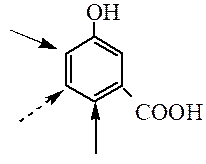
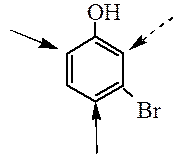
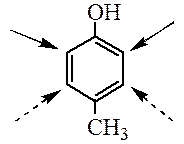
Реакции моноядерных аренов:
Галогенирование. Бензол в обычных условиях не взаимодействует с хлором или бромом. Реакция протекает только в присутствии катализаторов – кислот Льюиса:
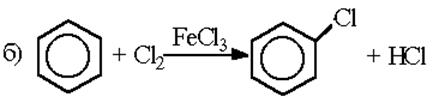
Роль катализатора заключается в поляризации нейтральной молекулы галогена, ведущей к образованию электрофильной частицы. Механизм реакции хлорирования может быть представлен следующим образом:
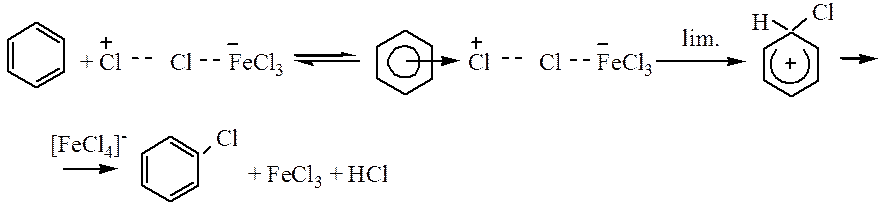
Алкилбензолы, вследствие электронодонорного эффекта алкильных групп более реакционноспособны в реакциях электрофильного замещения, чем бензол:
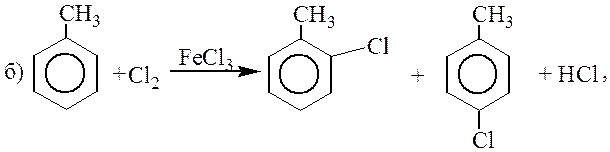
Фторирование протекает слишком бурно, и уже при комнатной температуре происходит деструкция молекул субстрата. Иодирование протекает очень медленно.
Нитрование. Бензол реагирует с концентрированной азотной кислотой очень медленно даже при нагревании. При действии же смесью концентрированных азотной и серной кислот (нитрующая смесь) легко происходит замещение водорода в кольце на нитрогруппу:
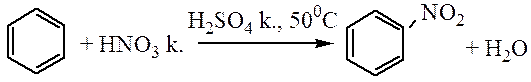
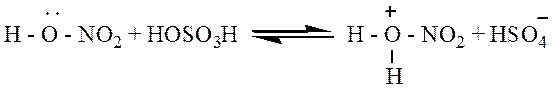 |

Алкилбензолы в реакциях нитрования более реакционноспособны, чем бензол:
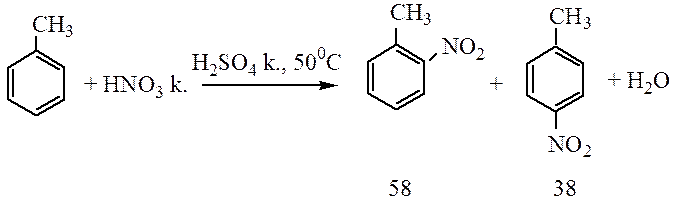
Сульфирование. При взаимодействии бензола с серной кислотой или олеумом происходит замещение водорода с образованием бензолсульфоновой кислоты:
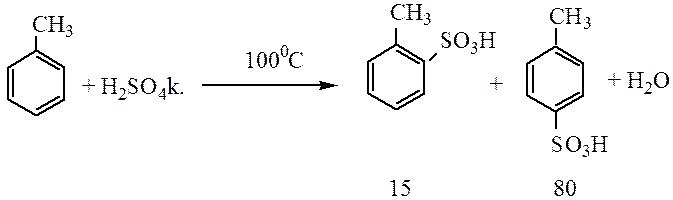
Сульфохлорирование. Взаимодействие с хлорсульфоновой кислотой, с образованием бензолсульфохлорида, который растворим в органических растворителях в отличае от бензолсульфоновой кислоты и его легче выделить из реакционной смеси.
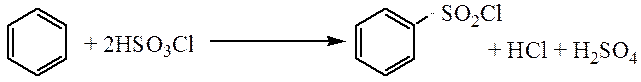
Алкилирование. В результате этой реакции в бензольное ядро вводятся алкильные группы с образованием гомологов бензола. В качестве алкилирующих реагентов можно использовать галогеналканы, алкены или спирты.
Алкилирование по Фриделю-Крафтсу (1877) осуществляется в присутствии кислот Льюиса:
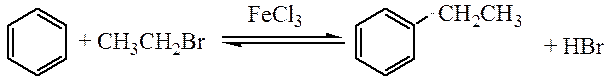
Вводимый алкильный заместитель, являясь электронодонором, активрует бензольное кольцо в реакциях электрофильного замещения, что может привести к полиалкилированию. Во избежание этого используется избыток ароматического углеводорода. Арены, содержащие сильные электронноакцепторные заместители, в реакцию алкилирования не вступают. Ароматиские амины, несмотря на наличие электронодонорной аминогруппы, в реакцию алкилирования тоже не вступают, что объясняется потерей активирующего действия аминогруппы за счет взаимодействия ее с катализатором.
Ацилирование. В качестве ацилирующего реагентов чаще всего используют хлорангидриды или ангидриды кислот. Ацилирование по Фриделю-Крафтсу осуществляется в присутствии кислот Льюиса.
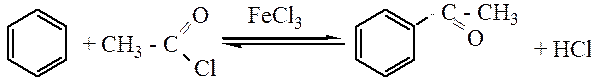
ацетофенон
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.