АРЕНЫ
Ароматические углеводороды (арены) – циклические углеводороды, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Классификация
По числу бензольных колец в молекуле арены подразделяются на:
моноядерные
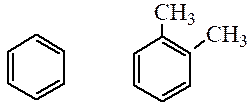
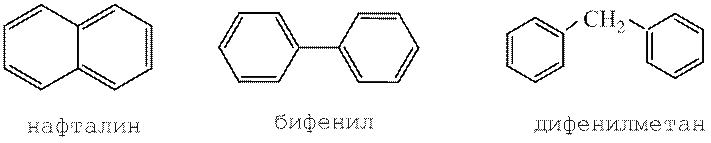
многоядерные
Номенклатура и изомерия
Структурным родоначальником углеводородов бензольного ряда служит бензол С6Н6 от которого строятся систематические названия гомологов.
Для моноциклических соединений сохраняются следующие несистематические (тривиальные) названия:
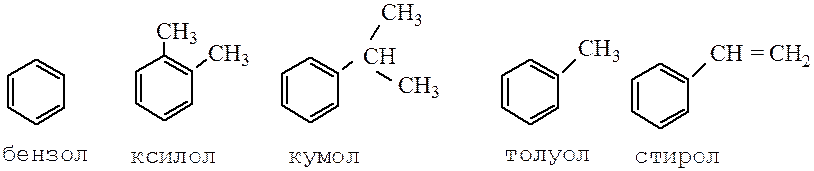
Положение заместителей указывают наименьшими цифрами (направление нумерации не имеет значения),
|
|
|
а для ди замещенных соединений можно использовать обозначения орто, мета, пара.
|
|
|
|
Если в кольце три заместителя тони должны получить наименьшие номера, т.е. ряд «1,2,4» имеет преимущество перед «1,3,4».
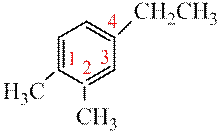
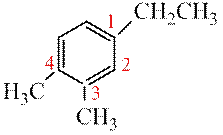
1,2-диметил-4-этилбензол (верное название) 3,4-диметил-1-этилбензол (неверно)
Изомерия монозамещенных аренов обусловлена строением углеродного скелета заместителя, у ди- и полизамещенных гомологов бензола добавляется ещё изомерия, вызванная различным расположением заместителей в ядре.
Изомерия ароматических УВ состава С9Н12:
|
|
|
|
|
Физические свойства
Температуры кипения и плавления у аренов выше, чем у алканов, алкенов, алкинов, малополярные, не растворимы в воде и хорошо растворимы в неполярных органических растворителях. Арены это жидкости или твердые вещества, имеющие специфические запахи. Бензолы и многие конденсированные арены токсичны, некоторые из них проявляют концерогенные свойства. Промежуточными продуктами окисления конденсированных аренов в организме являются эпоксиды, которые либо сами непосредственно вызывают рак, либо являются предшественниками канцерогенов.
Получение аренов
Многие ароматические УВ имеют важное практическое значение и производятся в крупном промышленном масштабе. Ряд промышленных способов основан на переработке угля и нефти.
Нефть состоит главным образом из алифатических и алициклических УВ, для превращения алифатических или ациклических УВ в ароматические разработаны способы ароматизации нефти, химические основы которых развиты Н.Д. Зелинским, Б.А. Казанским.
1. Циклизация и дегидрирование:
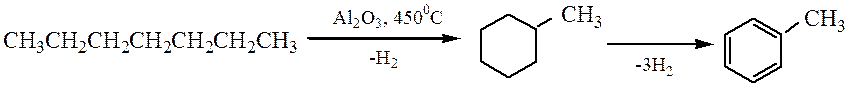
2. Гидродезметилирование:
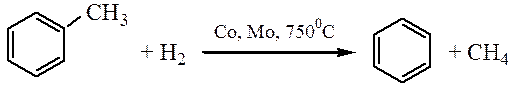
3. Гомологи бензола получают путем алкилирования или ацилирования с последующим восстановлением карбонильной группы.
а) Алкилирование по Фриделю-Крафтсу:
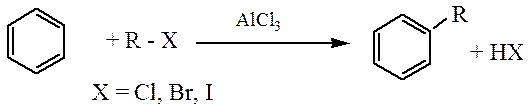
б) Ацилирование по Фриделю-Крафтсу:
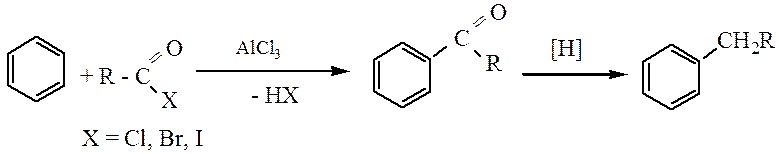
4. Получение бифенила по реакции Вюрца-Фитинга:
![]()
5. Получение дифенилметана по реакции Фриделя-Крафтса:
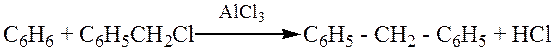
Строение и химические свойства.
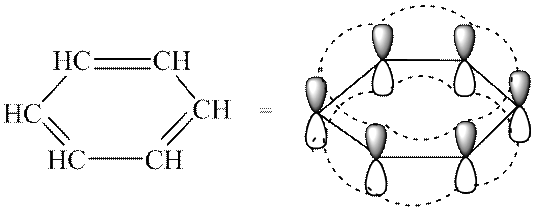
Критерии ароматичности:
На основании теоретических расчетов и экспериментального изучения циклических сопряженных систем было установлено, что соединение ароматично, если оно имеет:
Что дает ароматичность:
Несмотря на высокую степень ненасыщенности, ароматические соединения устойчивы к действию окислителей и температуры, они более склонны вступать в реакции замещения, а не присоединения. Эти соединения обладают повышенной термодинамической стабильностью, обеспечивающейся высокой энергией сопряжения ароматической системы кольца (150 кДж/моль), поэтому арены предпочтительней вступают в реакции замещения, в результате чего сохраняют ароматичность.
Механизм реакций электрофильного замещения в ароматическом кольце:
Электронная плотность π-сопряженной системы бензольного кольца является удобным объектом для атаки электрофильными реагентами.
Как правило, электрофильные реагенты генерируются в процессе реакции при помощи катализаторов и соответствующих условий.
Кат.
Е – Y → Eδ+ – Yδ- → E+ + Y-
Образование π-комплекса. Первоначальная атака электрофилом π-электронного облака кольца приводит к координации реагента с π-системой и образованию комплекса донорно-акцепторного типа называемого π-комплекса. Ароматическая система не нарушается:

Образование σ-комплекса. Лимитирующая стадия, на ней электрофил образует ковалентную связь с атомом углерода за счет двух электронов π-системы кольца, что сопровождается переходом данного атома углерода из sp2- в sp3-гибридное состояние и нарушением ароматической, молекула превращается в карбокатион.
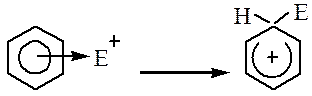
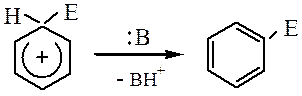
Влияние заместителей на реакционную способность и ориентацию электрофильного замещения
Заместители в бензольном кольце нарушают равномерность в распределении π-электронного облака кольца и тем самым оказывают влияние на реакционную способность кольца.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.