Основная часть поступивших в желудочно-кишечной тракт белков переваривается до смеси аминокислот, дипептидов и трипептидов и небольшое количество непереваренного белка выделяется с калом.
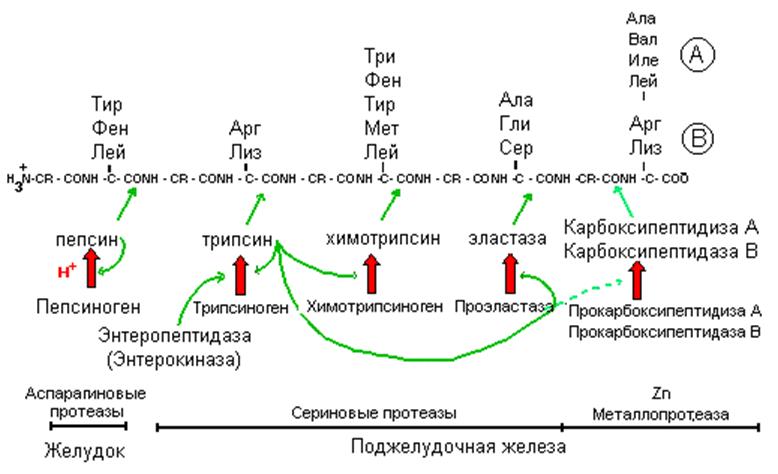 |
Схема протеолиза пищевых белков в желудочно-кишечном тракте.
ческих ферментов происходит расщепление белков. Они имеют различную специфичность и последовательно гидролизуют белки до аминокислот
Для переваривания белков необходимы:
· Водный раствор с различным значением рН и концентрацией электролитов создает условия, необходимые для оптимальной активности ферментов
· Предшественники ферментов - протеолитические ферменты синтезируются в виде неактивных предшественников (проферментов) и затем активируются в полости желудочно-кишечного тракта. Проферменты активируются путем ограниченного протеолиза.
· Слизь (мукопротеины) – высоковязкие растворы мукопротеинов действуют как смазочные средства, ускоряя прохождение пищи по ЖКТ.
Секрет клеток слизистой желудка носит название желудочный сок. Это опалесцирующая желтоватая жидкость, содержащая 0.2-0.5% НCl с рН 1.5. В состав желудочного сока входят неорганические соли, ферменты (пепсин, ренин и липаза) и мукопротеины.
Трудно получить продукты секреции париетальных клеток, свободных от загрязнения другими компонентами желудочного сока, но самые чистые образцы, которые были проанализированы представляют изотонические растворы. Их концентрация H + эквивалентна 0.17 N HCl, с pH около 0.87. Поэтому, секрет париетальных клеток можно рассматривать как изотонический раствор практически чистой HCl, которая содержит 150 мэкв Cl- и 150 мэкв Н в литре, хотя pH цитоплазмы париетальных клеток подобно другим клеткам, равен 7.0-7.2, а сопоставимые концентрации Cl- и Н+ на литр плазмы -100 мэкв и 0.00004 мэкв соответственно.
со
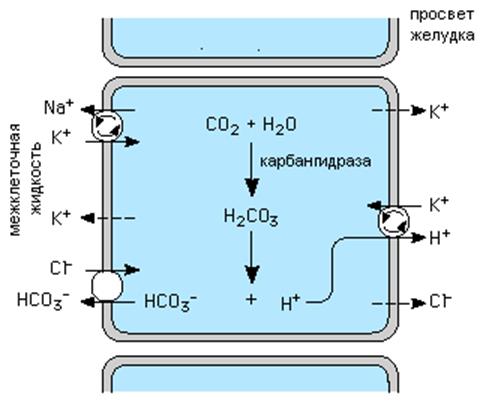 |
Механизм образования HCl.
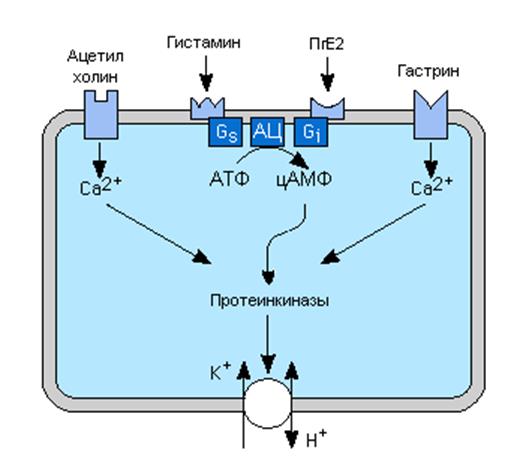 |
Регуляторы секреции HLl и их вторичные посредники.
Выход Cl- из клеток обеспечивается градиентом электрохимического потенциала через каналы апикальной мембраны, которые активируются цАМФ ; Н+ образуется путем диссоциации угольной кислоты, которая в свою очередь образуется в реакции гидратации СО2, катализируемой карбангидразой, ферментом, активность которого в париетальной клетке очень высокая. Второй компонент реакции диссоциации угольной кислоты HCO3- вытесняется из клетки на базолатеральной мембране париетальных клеток взамен на другой анион, главным образом на ион Cl- концентрация которого во внеклеточной жидкости самая высокая. Кровь во время секреции желудка сильно подщелачивается, что приводит в последующем к подщелачиванию мочи.
Секреция соляной кислоты стимулируется гистамином через H2 рецепторы, ацетилхолином через M3 мускариновые рецепторы, и гастрином, вероятно частично через гастриновые рецепторы в мембранах париетальных клеток. H2 рецепторы увеличивают внутриклеточный цАМФ при участии Gs белков, а мускариновые и гастриновые рецепторы проявляют свои эффекты, увеличивая концентрацию внутриклеточного свободного Ca2+. Действие одного из указанных регуляторов обычно потенцируeт ответ другого на возбуждение. Простагландины, особенно E ряда, ингибируют секрецию кислоты, активируя Gi белки, и это объясняет частично повышение риска язвенной болезни у людей, принимающих антивоспалительные препараты, которые ингибируют синтез простагландинов.
Циклическая АМФ и Ca2+ действуют через протеинкиназы, повышая транспорт H+ в желудочный просвет H+-K+ АТФазой.
Hсl понижает рН химуса, поступающего в желудок; денатурирует пищевые белки, создает оптимальный рН для действия пепсина и инициирует ограниченный протеолиз пепсиногена.
Пепсиноген — профермент пепсина с молекулярной массой 40 кД. Его активирование начинается обычно при участии Н+ и затем продолжается аутокатализом активными молекулами пепсина. В процессе активирования происходит удаление нескольких пептидов от N конца (42 аминокислоты), что снижает изоэлектрическую точку с рН 3.7 (пепсиноген) до
1.0 (пепсин). Пепсин в активном центре содержит остатки АСП, катализирует гидролиз внутренних пептидных связей (эндопептидаза) и обладает широкой специфичностью, преимущественно действуя на пептидные связи, образованные карбоксильными группами ароматических и больших алифатических аминокислот с образованием больших пептидных фрагментов.
Внутриполостное переваривание белков завершается ферментами поджелудочной железы
Панкреатический сок содержит ферменты, которые несут основную функцию в переваривании белков. Переваривание в кишечнике иногда называют панкреатическим перевариванием, поскольку основные ферменты образуются и секретируются поджелудочной железой. Сок поджелудочной железы имеет щелочную реакцию благодаря высокому содержанию HCO3- (около113 мэкв/л в сравнении с 24 мэкв/л в плазме). За сутки секретируется около 1500 мл панкреатического сока за сутки. Желчь и кишечные соки также нейтральны или щелочные, и все эти три секрета нейтрализуют соляную кислоту желудка, повышая pH дуоденального содержимого до 6.0-7.0 и еще более высокими становятся значения рН в нижних отделах тонкого кишечника.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.