Кристаллизацию проводили для растворов концентрацией 0,68 г/мл; 0,60 г/мл; 0,55 г/мл; 0,45 г/мл и 0,40 г/мл. Пересыщение создаётся за счёт увеличения концентрации растворённого вещества при испарении растворителя до значений, превышающих равновесное. Процесс осуществляется при постоянной температуре. Преимущественное испарение растворителя происходит «самопроизвольно», так как обеспечивается контакт раствора с атмосферой. При выращивании кристаллов испарение растворителя сопровождается обогащением раствора кислородом, соответственно изменяется его концентрация в кристалле. Интенсивнее испаряется жидкость по краю капли, поэтому в этой зоне и начинается процесс образования зародышевых центров. Так как жидкость обладает не высокой вязкостью, кристаллы в ней могут свободно перемещаться, поэтому под действием сил поверхностного натяжения в капле первые образовавшиеся кристаллы начинают стягиваться к центру. В освободившейся по краю зоне некоторое время ничего не происходит, пока не начнется новая волна массового зарождения кристаллов. Это связано с тем, что скорость роста кристаллов невысокая и быстрое испарение растворителя приводит к повышению степени пересыщения жидкости в объеме капли. Процессы диффузионного перераспределения растворенного вещества в жидкости не успевают пройти, поэтому по краям капля обедняется по содержанию кристаллизующегося компонента. Время, когда выделение новых зародышей затухает, необходимо для того, чтобы в капле прошли все диффузионные процессы и выравнивание концентрации по объему.
В ходе процесса кристаллизации соли различных концентраций наблюдали образование вытянутых призматических прозрачных кристаллов. Причём, в одном направлении – продольном – кристаллы гораздо длиннее, чем в поперечном. Количество зародышевых центров увеличивалось, из них образовывались новые сростки кристаллов до соприкосновения друг с другом. Также была выявлена кинетика закономерности затвердевания кристаллов солей. Результаты роста кристалла в продольном и поперечном направлении представлены в таблицах 3.1 – 3.4, в которых также приведена скорость роста кристаллов. Диаграммы скорости роста кристаллов из раствора соли различной концентрации изображены на рисунках 3.3, 3.9, 3.13, 3.16.
Процесс затвердевания капли нитрата Bi(NO3)3 – Er(NO3)3 концентрации 0,68 г/мл показан на рисунке 3.1.



Рисунок 3.2 – Кристаллы нитрата Bi(NO3)3 – Er(NO3)3, полученного совместным растворением оксидов, с концентрацией раствора 0,68 г/мл
Таблица 3.1 – Расчет скорости роста кристалла нитрата Bi(NO3)3 – Er(NO3)3, полученного совместным растворением оксидов, с концентрацией раствора 0,68 г/мл
|
Время, с |
Размер на экране, мм |
Фактический размер, мм |
Скорость роста, мм/с |
Скорость роста, мкм/с |
||||
|
продольное напр-е |
поперечное напр-е |
продольное направление |
поперечное направление |
продольное направление |
поперечное направление |
продольное направление |
поперечное направление |
|
|
35 |
10,22 |
1 |
0,3334421 |
0,03262643 |
||||
|
45 |
13,5 |
1,98 |
0,4404568 |
0,06460033 |
0,0107015 |
0,0031974 |
10,70147 |
3,19739 |
|
55 |
14,92 |
2,9 |
0,4867863 |
0,09461664 |
0,004633 |
0,0030016 |
4,632953 |
3,001631 |
|
65 |
16,68 |
3,88 |
0,5442088 |
0,12659054 |
0,0057423 |
0,0031974 |
5,742251 |
3,19739 |
|
75 |
18,3 |
4,58 |
0,5970636 |
0,14942904 |
0,0052855 |
0,0022838 |
5,285481 |
2,28385 |
|
85 |
19,48 |
5 |
0,6355628 |
0,16313214 |
0,0038499 |
0,0013703 |
3,849918 |
1,37031 |
|
95 |
20 |
6,3 |
0,6525285 |
0,20554649 |
0,0016966 |
0,0042414 |
1,696574 |
4,241436 |
|
105 |
20,3 |
6,5 |
0,6623165 |
0,21207178 |
0,0009788 |
0,0006525 |
0,978793 |
0,652529 |
|
115 |
20,7 |
6,5 |
0,675367 |
0,21207178 |
0,0013051 |
0 |
1,305057 |
0 |
|
125 |
21,16 |
7 |
0,6903752 |
0,22838499 |
0,0015008 |
0,0016313 |
1,500816 |
1,631321 |
|
135 |
21,2 |
7 |
0,6916803 |
0,22838499 |
0,0001305 |
0 |
0,130506 |
0 |
|
145 |
21,4 |
7 |
0,6982055 |
0,22838499 |
0,0006525 |
0 |
0,652529 |
0 |
|
155 |
21,78 |
7 |
0,7106036 |
0,22838499 |
0,0012398 |
0 |
1,239804 |
0 |
|
165 |
21,8 |
7 |
0,7112561 |
0,22838499 |
6,525E-05 |
0 |
0,065253 |
0 |
|
175 |
21,9 |
7,36 |
0,7145188 |
0,24013051 |
0,0003263 |
0,0011746 |
0,326264 |
1,174551 |
|
185 |
22 |
7,44 |
0,718 |
0,243 |
0,0003263 |
0,000261 |
0,326264 |
0,261011 |
|
среднее значение |
2,562262 |
1,400761 |
||||||
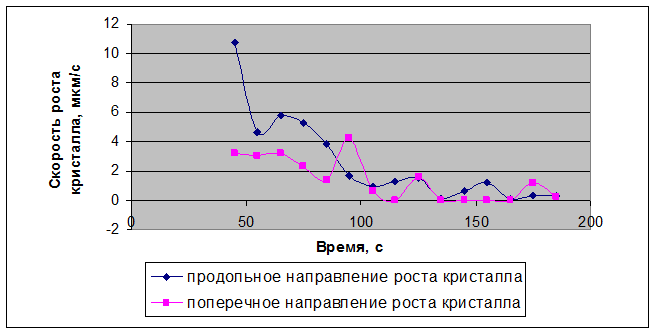
Рисунок 3.3 – Диаграмма скорости роста кристалла нитрата Bi(NO3)3 – Er(NO3)3, полученного совместным растворением оксидов, с концентрацией раствора 0,68 г/мл
Для кристалла нитрата Bi(NO3)3 – Er(NO3)3, полученного совместным растворением оксидов, с концентрацией раствора 0,68 г/мл – для размера кристалла в продольном направлении полученные статистические данные:
|
Коэффициент корреляции rxy |
0,88337804 |
|
Коэффициент детерминации R2 |
0,780356761 |
|
Критерий значимости Фишера F |
5,74962 *10-6 |
|
Уравнение регрессии |
|
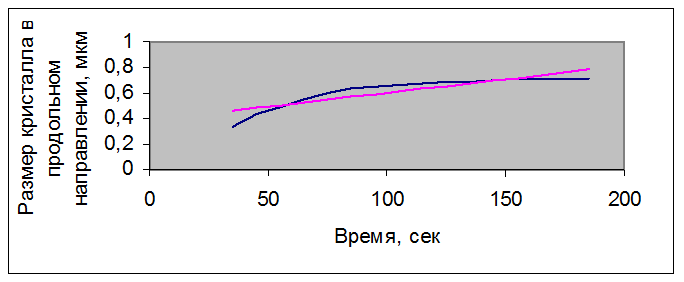
Рисунок 3.4 – Зависимость размера кристалла нитрата Bi(NO3)3 – Er(NO3)3, полученного совместным растворением оксидов, с концентрацией раствора 0,68 г/мл от времени
Для кристалла нитрата Bi(NO3)3 – Er(NO3)3, полученного совместным растворением оксидов, с концентрацией раствора 0,68 г/мл – для размера кристалла в поперечном направлении полученные статистические данные:
|
Коэффициент корреляции rxy |
0,909394348 |
|
Коэффициент детерминации R2 |
0,82699808 |
|
Критерий значимости Фишера F |
1,05489 *10-6 |
|
Уравнение регрессии |
|
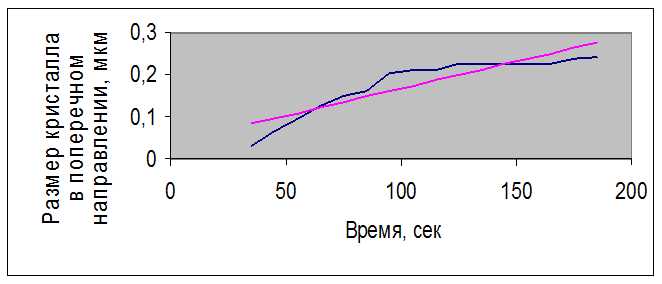
Рисунок 3.5 – Зависимость размера кристалла нитрата Bi(NO3)3 – Er(NO3)3, полученного совместным растворением оксидов, с концентрацией раствора 0,68 г/мл от времени
Все полученные значения удовлетворяют условиям и подтверждают гипотезу о линейной зависимости размера кристалла от времени.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.