Исходя из теории, описывающей механизмы роста кристаллов можно сделать следующее заявление. Для игольчатых кристаллов характерен рост по нормальному механизму, так как именно в этом случае наблюдается высокая скорость кристаллизации. Этот механизм проявляется в начальном периоде роста кристаллов при большом пересыщении и внешним его признаком является макроскопическое перемещение поверхности почти параллельно самой себе, что мы и имели возможность наблюдать. В процессе затвердевания происходит изменение концентрации растворенного вещества в объеме капли и наступает такой момент, когда степень пересыщения раствора становится недостаточно высокой для поддержания нормального механизма роста. С этого времени игольчатый рост прекращается и можно увидеть появление кристаллов правильной огранки. Гладкие грани, присущие кристаллу призматической формы, растут, как правило, послойно путем присоединения двумерных зародышей (рисунок 3.48) Скорость роста при этом значительно снижается, а условия кристаллизации становятся более равновесными.

Рисунок 3.48 – Кристаллы нитрата Bi(NO3)3 – Er(NO3)3 – La(NO3)3 при небольших степенях пересыщения
Таблица 3.15 – Результаты расчетов скоростей кристаллизации нитрата Bi(NO3)3 – Er(NO3)3 – La(NO3)3 при различных концентрациях раствора
|
Концентрация |
Средняя скорость роста в продольном направлении кристалла, мкм/с |
Средняя скорость роста в поперечном направлении кристалла, мкм/с |
|
0,68 |
6,805631 |
0,546191 |
|
0,60 |
5,899946 |
0,617183 |
|
0,55 |
3,754549 |
1,09926 |
|
0,45 |
0,910194 |
0,33463 |
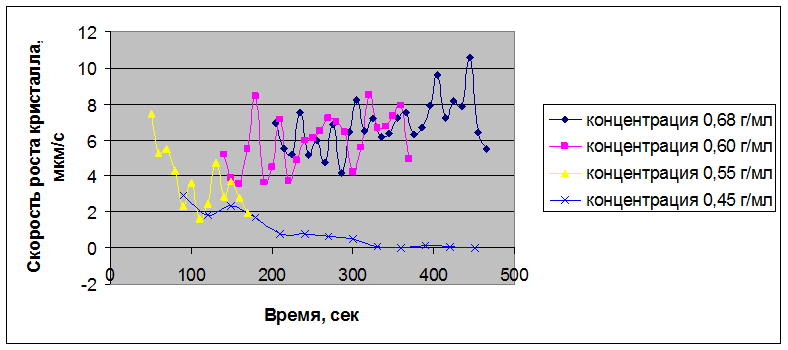
Рисунок 3.49 – Скорости кристаллизации нитрата Bi(NO3)3 – Er(NO3)3 – La(NO3)3 во времени при различных концентрациях раствора
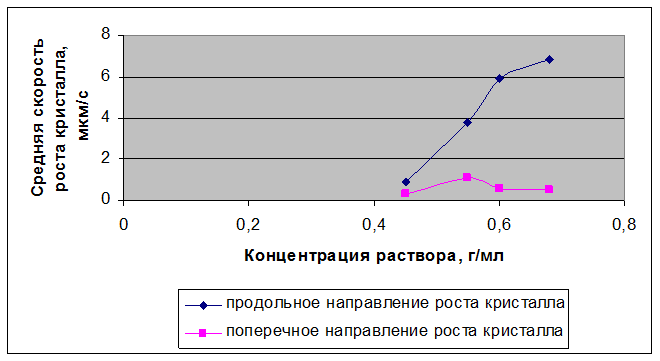
Рисунок 3.50 – Зависимости скорости кристаллизации нитрата Bi(NO3)3 – Er(NO3)3 – La(NO3)3 от концентрации
Как можно видеть из рисунков 3.2, 3.32, 3.41, помимо кристаллов правильной формы по краям капли появляются осадки в виде игл и плёнки. Это связано с тем, что однородное пересыщение всей системы осуществить гораздо сложнее, чем локальное пересыщение. Помимо этого на фотографиях видны выделения посторонних фаз, что связано с не до конца прошедшим фазообразованием в растворе (рисунок 3.15 б, в).
При кристаллизации нитратов концентрацией 0,40 г/мл и меньшей концентрации наблюдалось отсутствие кристаллов и появление плёнки. Это можно объяснить недостатком активных кристаллизационных центров при малом пересыщении раствора и значительной вязкости вещества. Затвердевание солей происходит аналогично аморфному веществу, и даже при больших увеличениях кристаллов не наблюдается (рисунок 3.51).


Рисунок 3.51 - Кристаллизации капли нитрата висмута-эрбия, полученного совместным растворением оксидов, концентрации 0,40 г/мл
На примере кристаллизации нитрата висмута-эрбия-лантана изучили влияние температуры окружающей среды, а соответственно и степени пересыщения раствора на скорость роста кристаллов. Для этого проводили кристаллизацию капли раствора при 15, 25, 35, 43 и 50 °С. Далее произвели замеры скоростей кристаллизации при каждой температуре и получили данные, представленные в таблице 3.16 и на рисунке 3.52.
Таблица 3.16 – Результаты расчетов скоростей кристаллизации нитрата висмута-эрбия-лантана при различных температурах
|
Температура, град |
Средняя скорость кристаллизации, мкм/с |
|
15 |
6,083016 |
|
25 |
5,899946 |
|
35 |
0,478103 |
|
43 |
0,903873 |
|
50 |
– |
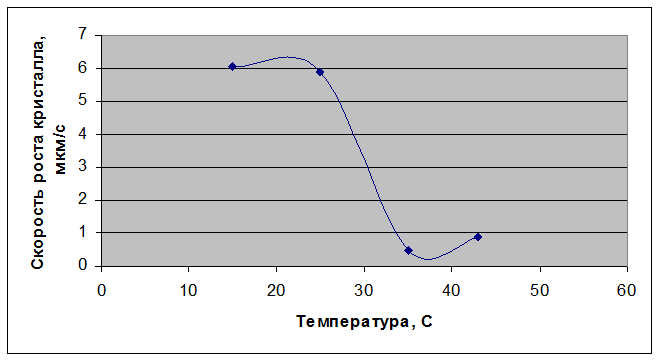
Рисунок 3.52 – Зависимость скорости кристаллизации от температуры
Из приведенной таблицы и рисунка видно, что при температуре раствора 15 °С возникший кристалл растет очень быстро и при этом имеет правильную огранку (рисунок 3.53, а). При повышении температуры раствора до 25 °С линейная скорость кристаллизации немного уменьшается, при этом форма растущего кристалла остается правильной (рисунок 3.53, б). Далее, при температуре 35°С и 45°С также наблюдается появление кристаллов с хорошо ограненной формой (рисунок 3.53, в, г), но скорость кристаллизации значительно снижается. При дальнейшем повышении температуры до 50°С наблюдается появление небольших кристаллов разветвлённой формы (рисунок 3.53, д). Объясняется это, очевидно, тем, что при более высоких температурах колебательные движения атомов усиливаются интенсивнее, нежели происходит испарение растворителя. За счёт этого скорость затвердевания заметно уменьшается. Таким образом, температурой можно регулировать скорость затвердевания.

Рисунок 3.53 – Формы кристаллов при кристаллизации в различных температурах
Изменение характера кристаллизации — переход от равновесной, хорошо ограненной формы кристалла к разветвленной форме роста — можно объяснить тем, что при повышении температуры происходят изменения в самом растворе в процессе кристаллизации. В первую очередь это касается концентрации растворенного вещества в жидкости, так как с увеличением температуры она значительно возрастает. Помимо этого большую роль при затвердевании играет степень переохлаждения. Так как раствор комнатной температуры кристаллизовался на поверхности, нагретой до разных температур, следовательно, чем сильнее была нагрета поверхность, тем больше был перепад температур при попадании раствора на чашку Петри. Это и приводит к тому, что изменяется линейная скорость кристаллизации, а значит и механизмы, по которым происходит рост кристаллов. Наглядно это можно увидеть на рисунке 3.53, где первоначально равновесная форма кристалла впоследствии становится сильно разветвленной, потому что сильное переохлаждение и высокая концентрация позволяют реализовываться тем направлениям роста в кристалле, проявление которых в равновесных условиях считается невозможным.
Также для процессов при 15°С и 35°С были посчитаны величины математической статистики.
Таблица 3.17 – Расчет скорости роста кристалла нитрата висмута-эрбия-лантана с концентрацией раствора 0,60 г/мл при температуре 15°С.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.