Рассмотренному выше случаю соответствует равенство коэффициентов диффузии веществ А и B (DА=DВ), которое, однако, сравнительно редко реализуется на практике. В наиболее общем случае DА≠DВ, и график зависимости концентрации от координаты при Т=Т1 имеет вид, качественно изображенный на рис. 1.3, откуда следует, что положение границы раздела (плоскости Матано, определяемой как плоскость, полный диффузионный поток через которую равен нулю) изменяется во времени, причем направление смещения зависит от соотношения коэффициентов диффузии в твердых растворах.
Графический материал, относящийся к системам с неограниченной растворимостью и с химическими соединениями, представлен на рис. 1.4, 1.5.
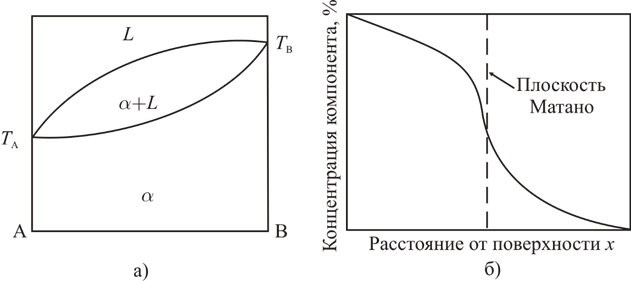
Рис. 1.4 Диаграмма состояния (а) и распределение концентрации компонентов при изотермической диффузии (б) в системе с неограниченной в жидком и твердом состоянии
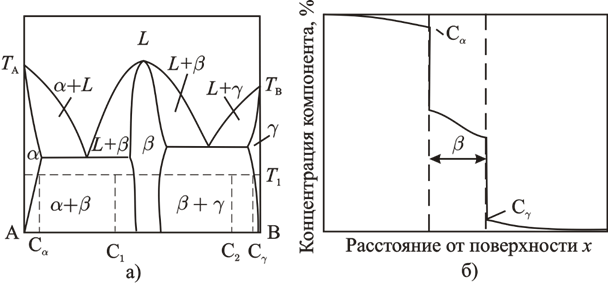
Рис. 1.5 Диаграмма состояния (а) и изменение состава диффузионной зоны (б) в бинарной системе, образующей химическое соединение и ограниченные твердые растворы
Параметры хлоридного процесса эпитаксии
Для выращивания эпитаксиального кремния применяются различные исходные кремнийсодержащие реагенты: тетрахлорид кремния SiCl4, трихлорсилан SiHCl3, дихлорсилан SiH2Cl2, моносилан SiH4 и даже дисилан Si2H6. Наиболее широко используют тетрахлорид кремния, поскольку изучен он лучше других. Рассмотрим на его примере химические процессы, протекающие в газовой фазе эпитаксиального реактора.
Суммарная реакция водородного восстановления кремния из его тетрахдорида
SiCl4 + 2Н2 « Si + 4HCl
не отражает полного механизма и не позволяет прогнозировать результаты процесса. Механизм этой реакции включает целый ряд промежуточных и конкурирующих стадий, например:
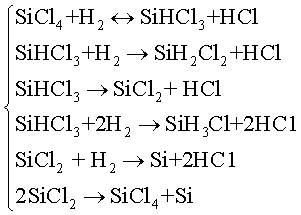 (3.1)
(3.1)
Практически все указанные выше исходные реагенты возникают в процессе водородного восстановления кремния. Поэтому часто термодинамический анализ, позволяющий определить состав газовой фазы и направление протекания процесса в целом, проводят для обобщенной системы Si – Н – С1, определяя лишь изначально величину параметра х, равного соотношению гипотетических давлений неконденсирующихся атомов, т.е. хлора и водорода:
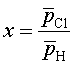 ,
(3.2)
,
(3.2)
где pCl, pH – соответствующие значения гипотетического давления атомов, равные сумме парциальных давлений компонентов газовой фазы, содержащих данный атом, с учетом стехиометрических коэффициентов, или
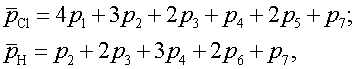 (3.3)
(3.3)
а также для атомов кремния ![]() , где
, где ![]() ,
,
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
а отношения гипотетических давлений атомов обозначают для неконденсирующихся
атомов
,
а отношения гипотетических давлений атомов обозначают для неконденсирующихся
атомов
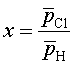 , а с участием конденсирующегося кремния
, а с участием конденсирующегося кремния
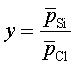 .
.
Термодинамический анализ начинают с определения констант равновесия возможных реакций в интересующем диапазоне температур. Для этого по справочным данным (табл. 3.1) рассчитывают значения свободной энергии Гиббса, т.е.
![]()
или
![]() , где с учетом заданного значения температуры
, где с учетом заданного значения температуры
![]() ,
,
![]() .
.
Таблица 3.1
Исходные данные для расчета констант равновесия реакций (3.1)
|
Компонент |
|
|
|
||
|
А |
В/10 |
С*10-5 |
|||
|
HCl |
-22,0 |
44,65 |
6,27 |
1,24 |
0,30 |
|
H2 |
0,0 |
31,21 |
6,52 |
0,78 |
0,12 |
|
Si |
0,0 |
4,5 |
5,70 |
0,70 |
-1,04 |
|
SiH4 |
7,3 |
48,87 |
15,38 |
4,88 |
-6,35 |
|
SiH3Cl |
-34,0 |
59,85 |
14,13 |
7,65 |
-3,82 |
|
SiH2Cl |
-75,0 |
58,47 |
20,34 |
2,58 |
-5,86 |
|
SiHCl3 |
-116,9 |
74,85 |
22,79 |
1,43 |
-4,76 |
|
SiCl4 |
-156,7 |
79,01 |
25,39 |
0,23 |
-3,51 |
|
SiCl2 |
-38,2 |
67,4 |
13,62 |
0,22 |
-1,26 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.