НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКУЛЬТЕТ ЕСТЕСТВЕННЫХ НАУК
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ
Курсовая работа
Определение термодинамических параметров реакции бис-ацетилацетоната меди (II) с пиридином спектрофотометрическим методом.
Выполнили: Иноземцева Е.А.
Чуланова Е.А.
Проверил: д.х.н. Талзи Е.П.
Новосибирск 2011 г.
Введение.
Одним из важных классов координационных соединений являются 2,4–дикетонаты переходных металлов. Вследствие значительной кислотности связи C-H фрагмента β-дикетонаты легко образуются и значительно устойчивы из-за кето-енольной таутомеризации.
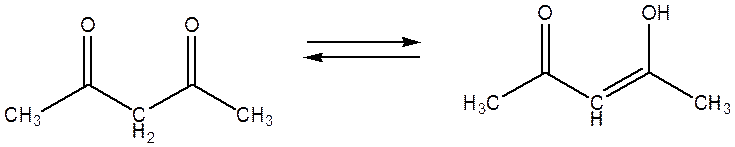
Дикетонатные комплексы нашли практическое применение в различных областях химии и химической технологии. Они применяются для очистки материалов от примесей методом зонной плавки, для получения металлических и оксидных пленок путем их термического разложения, а также для разделения и анализа смесей металлов методом газожидкостной хроматографии. Кроме того, дикетонаты металлов привлекают внимание исследователей своей способностью катализировать различные химические процессы.
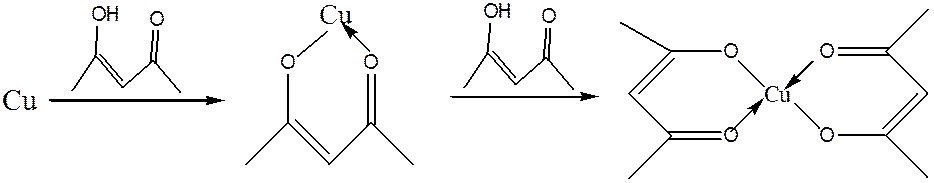 Наиболее устойчивыми являются пяти- и шестичленные хелатные
комплексы, в частности, ацетилацетонаты переходных металлов и их производные.
Ацетилацетон образует устойчивые соединения со многими металлами, такими как Al, Co, Cu, Fe, Mn, Ni и др. При этом возможна координация как одной молекулы
ацетилацетона, так и двух:
Наиболее устойчивыми являются пяти- и шестичленные хелатные
комплексы, в частности, ацетилацетонаты переходных металлов и их производные.
Ацетилацетон образует устойчивые соединения со многими металлами, такими как Al, Co, Cu, Fe, Mn, Ni и др. При этом возможна координация как одной молекулы
ацетилацетона, так и двух:
Комплексы ацетилацетона характеризуются легкостью образования и значительной устойчивостью. Поскольку дикетонаты переходных металлов имеют способность образовывать различные комплексы, то удобным способом анализа термодинамики процессов комплесксообразования с участием дикетонатов является метод спектрофотометрии. Большинство дикетонатов переходных металлов поглощают в видимой области спектра. При координации каких-либо молекул к дикетонату наблюдается изменение спектра поглощения, что может быть использовано для исследования процессов комплексообразования.
Целью данной работы является определение термодинамических параметров реакции бис-ацетилацетоната меди (II) с пиридином.
Общая часть.
Для изучавшейся нами системы бисацетилацетонат меди (II) – пиридин/ хлороформ характерна координация только одной молекулы пиридина к комплексу, устанавливается равновесие
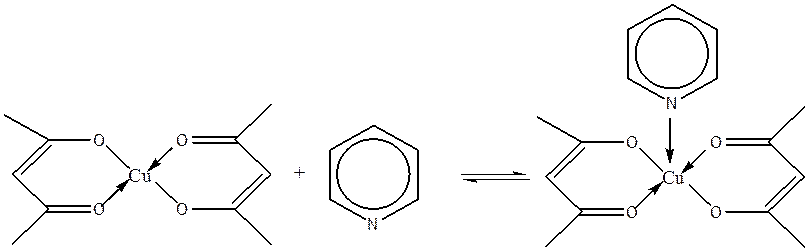
В качестве растворителя использовали смесь хлороформа с толуолом в соотношении 1:1.
Изучение равновесия удобно проводить спектрофотометрическим методом, т.к. максимумы поглощения исходного вещества и продукта лежат в красной области видимого света.
При взаимодействии Cu(acac)2 с пиридином (Py) меняется интенсивность поглощения, т.е. при изменении концентрации пиридина будет изменяться оптическая плотность анализируемого раствора.
Т.к. в исследуемом растворе присутствуют две поглощающие формы – исходный ацетилацетонат и образующийся комплекс с пиридином, оптическая плотность раствора при любой длине волны складывается из оптических плотностей двух поглощающих форм (в силу аддитивности):
![]()
Используя закон Бугера-Ламберта-Бэра преобразуем выражение для оптической лотности раствора, получим:
![]()
Константа равновесия изучаемой реакции, по определению, равна
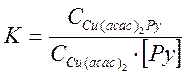
С учетом того, что начальная концентрация (Со) ацетилацетоната меди равна
![]()
равновесные концентрации ацетилацетоната и его пиридинового комплекса равны соответственно
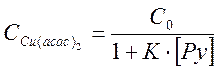 ,
,
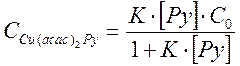
Подставив все значения в выражение для оптической плотности, получим
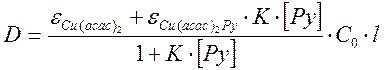
Do - оптическая плотность раствора, не содержащего пиридин, тогда
![]()
Рассчитаем разницу оптических плотностей раствора до и после прибавления пиридина:
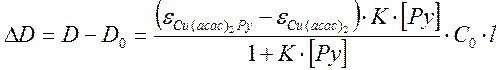
Обозначив разницу коэффициентов экстинкции за Δε, и приняв в учет, что при рабочих концентрациях начальная концентрация пиридина много больше, чем равновесная концентрация комплекса Cu(acac)2Py, поэтому [Py] = СPy . С учетом этого запишем выражение для 1/ ΔD.
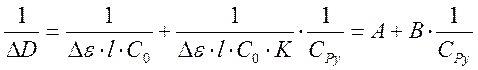
Полученное выражение показывает линейную зависимость 1/ ΔD от 1/CPy.
Экспериментальная часть.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.