


















Свойства полученной оксидной пленки оказывают значительное влияние на дальнейшее развитие химической коррозии. Когда оксидный первичный слой образует сплошную пленку, она будет тормозить в дальнейшем окисление металла, т.к. реагирующее вещества должны будут диффундировать через нее. Если оксидная пленка получается пористой, то она не сможет препятствовать контакту реагирующих веществ и коррозия будет продолжаться. В зависимости от условий при окислении чистого железа получается оксид железа FeO (вюстит), окись железа Fe2O3 (гематит) или оксид железа Fe3O4 (магнетит) по следующим реакциям:
2 Fe + О2↔2FeO;
3Fe + 2О2↔Fe3O4;
4Fe + 3О2↔2Fe2O3;
Установлено, что вюстит FeO при химической коррозии обладает меньшим защитным действием, чем Fe2O3 (гематит) и Fe3O4 (магнетит).
По условиям протеканияк этому виду относятся:
— газовая коррозия, т.е. окисление металла в газовой среде при высокой температуре и невозможности конденсации влаги на поверхности металла; В сухих окислительных газах при повышенных температурах на поверхности большинства конструкционных металлов образуется слой твердых продуктов коррозии (окалина)
— коррозия в неэлектролитах, т.е. в жидкостях некоторых жидких органических соединениях, непроводящих электрический ток.
Пример химической коррозии – разрушение железа под действием перегретого пара.
Считают, что коррозия в паре, начиная с температуры 570 °С, является химической. В настоящее время предельная температура перегрева для всех котлов снижена до 545°С, и, следовательно, в пароперегревателях происходит электрохимическая коррозия
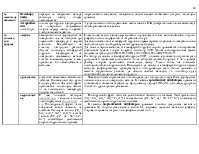
Основные факторы, влияющие на скорость химической коррозии, являются:
- природа металла;
- состав газовой среды (н-р, продукты сгорания топлива);
- механические свойства образующихся продуктов коррозии (оксидных пленок);
- температура.
К электрохимической коррозии относятся все электрохимические реакции, разрушающие металл и протекающие на его поверхности с возникновением электрического тока между отдельными участками. (взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окисленного компонента коррозионной среды (деполяризатора) протекают не в одном акте). При этом виде коррозии одновременно протекают две реакции – окисления и восстановления, локализованные на определенных участках поверхности корродирующего металла. При электрохимической коррозии процесс растворения металла сопровождается появлением электрического тока, т.е. передвижением электронов по поверхности металла и ионов в растворе электролита от одного участка к другому.
Она наиболее распространена в среде жидкого электролита, т.е. в среде, проводящей электрический ток. Такими средами могут быть природная вода, водные растворы солей, кислот, щелочей, а также воздух и пар, содержащий влагу, т.е. электрохимическая коррозия – разрушение в атмосфере, на почве, водоёмах, грунтах.
Электрохимическая коррозия металлов в водной среде наблюдается при наличии деполяризаторов: кислорода, ионов водорода и др. При одновременном содержании в воде О2 и СО2 коррозионный процесс идет преимущественно с кислородной деполяризацией. Когда в воде кислород отсутствует, но есть углекислота поставляющая в раствор ионы водорода создаются условия для протекания коррозии с водородной деполяризацией.
Суммарная реакция коррозии железа с кислородной деполяризацией может быть записана так:
3Fe + 2О2+ 2Н2О↔2Fe(OН)2;
При достаточно большой концентрации кислорода и щелочной реакции двухвалентное – закисное железо Fe2+ окисляется кислородом в трехвалентное – Fe3+ по формуле: 4Fe(OН)2 + О2+2 Н2О→4 Fe(OН)3
Электрохимическая коррозия металлов с водородной деполяризацией протекает в растворах кислот, характеризующихся повышенной концентрацией ионов водорода. Н-р, при наличии в воде растворенного диоксида углерода СО2 образуются молекулы угольной кислоты Н2СО3, диссоциирующей на ионы Н+ и НСО3-.
По условиям протекания к электрохимическому виду коррозии относятся:
— атмосферная коррозия - протекает во влажной газовой или воздушной
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.