














|
ТУРБУЛЕНТНЫЙ ПОГРАНИЧНЫЙ СЛОЙ
С ХИМИЧЕСКИМИ РЕАКЦИЯМИ
|
роблема пограничного слоя с химическими реакциями
представляет самостоятельный интерес. Она охватывает широкий круг явлений, начиная с различных видов горения топлив и кончая взаимодействием высокоскоростных газовых потоков с химически активными поверхностями. Большое практическое значение имеют реакции углерода с газами, поскольку графит и другие углеродсодержащие материалы широко применяются в различных отраслях современной техники. Значительная часть потребности в энергии удовлетворяется путем прямого или косвенного использования реакций углерода с газами.
В пограничном слое могут происходить
как гомогенные, так и гетерогенные химические реакции.
Гетерогенные – когда твердая стенка сама принимает участие в реакциях.
Скорость гетерогенных реакций обусловлена двумя факторами: 1) диффузией
реагирующего газа из невозмущенного потока через пограничный слой к поверхности,
2) скоростью протекания самой химической реакции (реакционной способностью).![]()
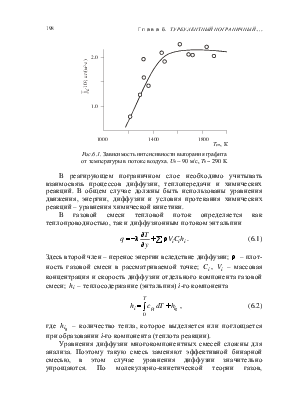
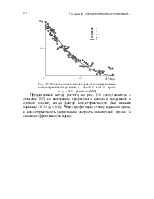
При низких температурах скорость протекания химической реакции ниже скорости диффузии, поэтому определяющим является кинетический режим. С увеличением температуры скорость реакции возрастает и преобладающей всего процесса является скорость диффузии, что характеризует диффузионный режим реагирования. На рис. 6.1 показана зависимость интенсивности выгорания графита в потоке воздуха от температуры стенки. Видно, что при температурах до 1400 К наблюдается сильная зависимость от температуры, что характерно для кинетического режима, при Тcт > 1400 К имеет место диффузионный режим.
|
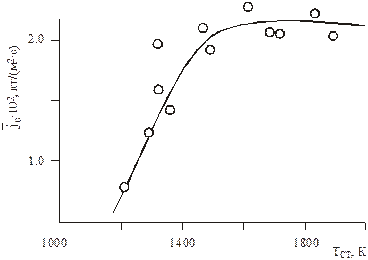
Рис.6.1. Зависимость интенсивности выгорания графита
от температуры в потоке воздуха. U0 ~ 90 м/с, T0 ~ 290 K
В реагирующем пограничном слое необходимо учитывать взаимосвязь процессов диффузии, теплопередачи и химических реакций. В общем случае должны быть использованы уравнения движения, энергии, диффузии и условия протекания химических реакций – уравнения химической кинетики.
В газовой смеси тепловой поток определяется как теплопроводностью, так и диффузионным потоком энтальпии
![]() .
(6.1)
.
(6.1)
Здесь второй член
– перенос энергии вследствие диффузии; ![]() –
плот-ность газовой смеси в рассматриваемой точке;
–
плот-ность газовой смеси в рассматриваемой точке; ![]() ,
, ![]() – массовая
концентрация и скорость диффузии отдельного компонента газовой смеси;
– массовая
концентрация и скорость диффузии отдельного компонента газовой смеси; ![]() –
теплосодержание (энтальпия) i-го
компонента
–
теплосодержание (энтальпия) i-го
компонента
![]() ,
(6.2)
,
(6.2)
где ![]() – количество
тепла, которое выделяется или поглощается при образовании i-го компонента (теплота реакции).
– количество
тепла, которое выделяется или поглощается при образовании i-го компонента (теплота реакции).
Уравнения диффузии многокомпонентных смесей сложны для анализа. Поэтому такую смесь заменяют эффективной бинарной смесью, в этом случае уравнения диффузии значительно упрощаются. По молекулярно-кинетической теории газов, диффузионный поток вещества зависит от концентрационной диффузии, термодиф-
фузии и бародиффузии, т. е.
![]()
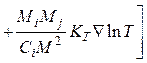 .
(6.3)
.
(6.3)
Здесь KT = DT /Dij – термодиффузионное отношение; Ci, Cj – концентрации компонентов; Mi, Mj – молекулярные массы компонентов; Dij, DT – коэффициенты концентрационной и термической диффузии.
В приближении теории
пограничного слоя ![]() бародиффузия
исключается. Влияние термодиффузии мало (~10 %). Поэтому определяющей является
концентрационная диффузия и справедлив закон Фика
бародиффузия
исключается. Влияние термодиффузии мало (~10 %). Поэтому определяющей является
концентрационная диффузия и справедлив закон Фика
![]() .
(6.4)
.
(6.4)
Выразим первый член в (6.1) через полное теплосодержание смеси газов в рассматриваемой точке
![]() ,
(6.5)
,
(6.5)
откуда получим
![]() .
(6.6)
.
(6.6)
Подставляя (6.4) и (6.6) в (6.1), найдем
![]() ,
(6.7)
,
(6.7)
где ![]() – критерий
Льюиса,
– критерий
Льюиса, ![]() ,
, ![]() .
.
Для газов в большинстве случаев
критерий Льюиса близок к единице (![]() )
и выражение для потока тепла упрощается
)
и выражение для потока тепла упрощается
![]() .
(6.8)
.
(6.8)
В такой форме уравнение передачи тепла не зависит от механизма теплообмена и от скорости химических реакций. Дифференциальное уравнение энергии пограничного слоя с учетом (6.8) должно быть записано через полное теплосодержание газа:
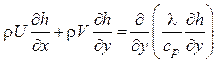 .
(6.9)
.
(6.9)
Уравнение диффузии i-го компонента газовой смеси с учетом (6.4) имеет вид
![]() .
(6.10)
.
(6.10)
Здесь ![]() – скорость
образования i-го компонента
в результате химической реакции в рассматриваемой точке, т. е. при химических
реакциях концентрации отдельных компонентов газа могут меняться. Наличие этого
члена приводит к неподобию дифференциальных уравнений энергии (6.9) и диффузии
(6.10).
– скорость
образования i-го компонента
в результате химической реакции в рассматриваемой точке, т. е. при химических
реакциях концентрации отдельных компонентов газа могут меняться. Наличие этого
члена приводит к неподобию дифференциальных уравнений энергии (6.9) и диффузии
(6.10).
Массовые же доли отдельных химических элементов во время реакций
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.