является полным дифференциалом, а функция s есть функция состояния системы и называется энтропией. Как функция состояния системы энтропия однозначно определяется любой парой термодинамических параметров состояния: s = s1(p, v), s = s2(p, T), s = s3(v, T). Энтропия S для m кг газа равна: S = m×s, Дж/К.
За начало отсчета энтропии для газов принимают условное начало отсчета при температура Т=0 оС, для которого s0=0.
За начало отсчета энтропии для воды и водяного пара принята так называемая тройная точка (Т=273.16 К и р=0.0006 Па).
Для расчета изменения энтропии идеального газа используются формулы:
Ds = s2 – s1 = cvlnT2/T1 + Rln(v2/v1), (1.32)
где cv = const; и
Ds = cplnT2/T1 – Rlnp2/p1, (1.33)
где cp = const.
Параметры u, h, s однозначно описывают любое состояние термодинамической системы и называются калорическими параметрами состояния. Между калорическими u, h, s и термическими p, v, T параметрами существует взаимно однозначное соответствие.
Если первый закон термодинамики в виде
dq = du + pdv
объединить с dq =Tds из (1.31), то получим
Tds = du + pdv, (1.34)
называемое термодинамическим тождеством или основным уравнением термодинамики.
1.8.3.Ts-диаграмма
Поскольку энтропия есть функция состояния произвольной термодинамической системы, то каждое ее состояние однозначно отображается точкой на плоскости T,s. Процесс в Ts-диаграмме изображается, как и в любой термодинамической диаграмме состояния, линией.
С помощью параметров состоянияр, v, T, а также u, h нельзя графически изображать количество теплоты так, как, например, можно изобразить работу в p,v-координатах. Энтропия как параметр состояния позволяет это сделать в Ts-координатах.
Из (1.31) для обратимых процессов имеем
dq = Tds (1.35) или
q = òT(s)ds. (1.36)
Для вычисления удельной теплоты процесса по формуле (1.36) необходимо знать функцию T(s). В Ts-координатах количество подведенной к системе (или отведенной от нее) теплоты в обратимом процессе изображается в виде площади под кривой процесса (рис.1.12), т.е.
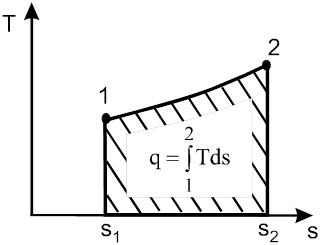 |
Рис.1.12. Изображение теплоты процесса 1-2 в Ts-диаграмме.
Из (1.35) следует, что количество подведенной и отведенной теплоты зависит от характера процесса изменения энтропии. Если ds > 0, то dq > 0, т.е. теплота подводится к системе, и, наоборот, если ds < 0, то и dq < 0 – теплота отводится от системы.
Ts-диаграмма удобна и наглядна для анализа термодинамических процессов и циклов. При ее построении обычно за нуль энтропии условно принимается ее значение при температуре 0 оС=273.15 К и давлении 101325 Па.
1.8.4.Круговые процессы. КПД цикла
Цикл, в результате которого производится работа, называется прямым циклом или циклом теплового двигателя. Цикл, в результате которого расходуется работа, называется обратным или циклом холодильной машины.
Циклы, состоящие только из равновесных обратимых процессов, называются идеальными. Если один из процессов, составляющих цикл, необратим, то и весь цикл будет необратимым.
По определению равновесного процесса равновесный подвод и отвод теплоты предполагают равенство или бесконечно малую разницу температур между горячим и холодным источниками и рабочим телом в каждой точке процесса. Следовательно, для осуществления равновесного обратимого идеального цикла необходимо иметь рабочее тело, совершающее круговой процесс с функцией T(s), и соответствующий этой функции набор горячих и холодных источников теплоты q1(T1) и q2(T2).
Для прямого обратимого цикла теплового двигателя q1 > 0, а q2 < 0, и суммарное количество теплоты, полученное рабочим телом за цикл, составит
qц = q1 – q2, где q1 и q2 – соответственно подведенная и отведенная теплота.
Запишем уравнение первого закона термодинамики для данного случая:
qц = Du + lц.
Объединяя эти два уравнения, с учетом того, что для обратимого цикла òdu = Du = 0, получим
lц = q1 – q2, (1.38)
т.е. алгебраическая сумма подведенной и отведенной за цикл теплоты перешла в работу цикла. Ясно, что работа равновесных обратимых циклов максимальна, поскольку они являются по определению идеальными.
Если же цикл будет необратимым из-за необратимости хотя бы одного из составляющих его процессов, то появляются дополнительные внутренние потери теплоты на трение, вихреобразование и др. Это приводит к увеличению q2 и, соответственно, к уменьшению (q1 – q2), т.е. к уменьшению работы цикла lц. Следовательно, работа необратимого цикла меньше работы обратимого
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.