1)Совершенные растворы - это растворы, в которых и растворитель и растворенные вещества обладают сходным химическим строением и имеют близкие термодинамические характеристики, например растворы оптических изомеров, или растворы изотопов.
2)Закон Рауля выполняется с
абсолютной точностью во всем интервале концентраций. (![]() )
)
3) Pобщ = ∑pi (по закону Дальтона общее давление пара над идеальном раствором равно сумме парциальных давлений пара компонентов).
|
|
|
|


|
|
 |
Для бинарной смеси жидкостей,находящихся в равновесии с паровой фазой,химические потенциалы данного компонента в паровой и жидкой фазах равны между собой.Связь между составами жидкой и паровой фаз для равновесия в гетерогенной системе, устанавливают, используя формулы закона Рауля для идеального раствора.
По закону Рауля: pА=Р0А*х1 и pВ=Р0В*(1-х1)
По закону Дальтона: y1 = pA/(pA+pB) и y2 = pB/(pA+pB)
Разделив формулы закона Рауля друг на друга, получим:
pA/pB = P0A/P0B * x1/(1-x1)
Затем разделим формулы з-на Дальтона и получим:
pA/pB = у1/(1-у1)
При равновесии можно приравнять получившиеся выражения:
y1/(1-у1) = Р0А/Р0В * х1/(1-х1)
Р0А/Р0В = α коэф. относительной летучести, характеризует легкость разделения компонентов при ректификации.
При образовании раствора, когда в чистый раст-ль вводится растворенное вещество,появляется новая структура с иным расположением частиц,чем в чистом растворителе,которая будет зависеть от состава раствора и будет специфична для каждого раствора.Изменяются и силы ММВ.В растворе кроме взаимодействия между однородными молекулами появляется взаимодействие и между разнородными частицами.Частицы растворенного вещества взаимодействуют друг с другом и с мол-ми раст-ля.Это является причиной отклонения давления паров над раствором от з-на Рауля.
«+» и «-» отклонения обусловлены разными факторами:
Если разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные, т.е. FA-B < FA-A, то это облегчит переход из жидкой фазы в паровую (по сравнению с чистыми жидкостями) и будут наблюдаться положительные отклонения.
Усиление взаимного притяжения в разнородных молекулах (сольватация, водородная связь, образование химического соединения) затрудняет переход в газовую фазу и будут наблюдаться отрицательные отклонения.
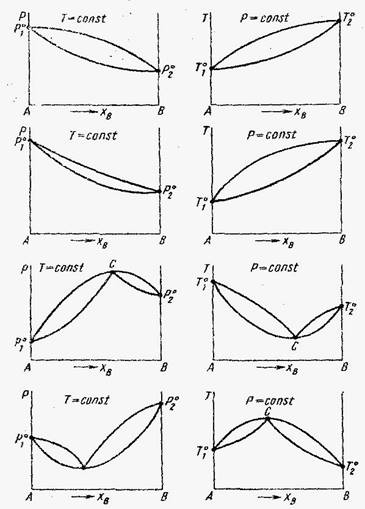
I)
II)
III)
IV)
I – Растворы с незначительными положительными отклонениями.
II – Растворы с незначительными отрицательными отклонениями.
III – Расворы со значительными положительными отклонениями.
IV – Растворы со значительными отрицательными отклоненями.
«+» и «-» отклонения обусловлены разными факторами:
Если разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные, т.е. FA-B < FA-A, то это облегчит переход из жидкой фазы в паровую (по сравнению с чистыми жидкостями) и будут наблюдаться положительные отклонения.
Усиление взаимного притяжения в разнородных молекулах (сольватация, водородная связь, образование химического соединения) затрудняет переход в газовую фазу и будут наблюдаться отрицательные отклонения.
Растворы со значительными положительными или отрицательными отклонениями от идеальности способны образовывать азеотропные смеси, которые на диаграммах состояния изображены точкой с. Азеотропные смеси – это растворы при испарении которых получается пар того же состава, что и исходная жидкая смесь. В реальных растворах азеотропная смесь имеет самую низкую или самую высокую температуру кипения.При изменении внешнего давления изменяется не только Ткип,но и состав азеотропного раствора, т.е. азеотропная смесь не является хим. соединением. Азеотропные смеси образуются не только в системах со значительными отклонениями от з-на Рауля,но и в системах с незначительными отклонениями,если компоненты раствора имеют близкие Ткип, т.е. почти одинаковые давления пара над чистыми компонентами. В этом случае на диаграмме состояния появляется экстремум, лежащий в средней части диаграммы.Чем больше различие между Р01 и Р02 тем больше положение экстремума сдвинутов сторону одного из компонентов:при максимуме – в сторону более летучего;при минимуме – в сторону менее летучего.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.