



13. Основи теорії швидкої та повільної коагуляції Смолуховського.
Кінетику швидкої коагуляції розробив Смолуховський у 1916 р. Розглядаючи коагуляцію як реакцію другого порядку (оскільки одночасне зіткнення більшої кількості колоїдних частинок малоймовірне), Смолуховський вивів рівняння для розрахунку кількості частинок, що скоагулювали або залишилися у золі на даний момент часу τ:
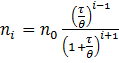
де n0 – початкова кількість частинок ; і – порядок агрегатів частинок (одиничних, подвійних, потрійних тощо), θ – час половинної коагуляції, за який початкова кількість частинок зменшиться вдвічі.
Сумарна кількість частинок усіх порядків Σn на час τ визначається рівнянням
![]() або
або ![]()
де К – константа швидкості коагуляції.
З даного рівняння випливає, що при τ = θΣn = n0/2. Константа швидкості К і час половинної коагуляції пов’язані між собою співвідношенням
![]()
Вважаючи, що при ΔЕ = 0 всі зіткнення частинок ефективні (стеричний фактор Р = 1), константа швидкості швидкої коагуляції Кш описується формулою
![]() .
.
Отже, константа швидкості швидкої коагуляції залежить лише від температури та в’язкості дисперсного середовища.
Для повільної коагуляції характерні умови, коли ΔЕ ≠ 0 і не всі зіткнення частинок ефективні (стеричний фактор Р ≠ 1). Константу швидкості повільної коагуляції визначають за рівнянням
![]()
Якщо ΔЕ>>кТ, то швидкість коагуляції близька до нуля і система може бути агресивно-стійною. В цій теорії використовують уявлення про коефіцієнт сповільнення W, який показує, у скільки разів константа швидкості повільної коагуляції менша за константу швидкості швидкої коагуляції:
![]() .
.
Коефіцієнт W іноді називають фактором стійкості, або коефіцієнтом стабільності.
17. Характеристика конденсаційних, диспергаційних методів одержання колоїдних систем.
Метод конденсації полягає в укрупненні частинок під час агрегації молекул або іонів. Конденсація може бути фізичною та хімічною. В обох цих випадках у гомогенному середовищі маємо справу з тонко дисперсною фазою, яка утворюється внаслідок пересичення розчину або пари. У разі виникнення місцевих пересичень у розчині виникають агрегати із кількох молекул, які стають зародками нової фази. Роль зародків можуть виконувати пилинки або невелика кількість готового золю, що вносяться в систему ззовні. Дисперсність одержаного золю залежить від наявності центрів кристалізації та швидкості росту кристалів.
За сучасною теорією процес утворення зародків флуктуаційний і визначається залежністю
![]()
де r – розмір кристала; VM – молярний об’єм рідини; Cr і C∞ - концентрації відповідно пересиченого та насиченого розчинів.
Утворення зародків можливе за умови, якщо Cr > C∞. З пересиченого розчину високодисперсну систему можна одержати тоді, коли швидкість утворення зародків буде набагато більшою, ніж швидкість їх росту.
За хімічної конденсації нова фаза виникає під час проведення реакції, в результаті яких утворюється нерозчинна у даному середовищі речовина.
Диспергуванням називають тонке подрібнення твердих матеріалів або рідин до колоїдних розмірів і розподіл їх частинок у рідкому або газовому середовищі. Методи диспергування поділяються на механічні, фізичні та фізико-хімічні.
Механічний метод – один із основних методів одержання колоїдних розчинів у природі. Штучне механічне подрібнення проводять за допомогою звичайних і колоїдних млинів. На подрібнення речовини витрачається енергія W, що дорівнює сумі роботи деформації твердого тіла Wдеф та роботи утворення нових поверхонь Wпов:
![]()
де К – коефіцієнт пропорційності, який дорівнює деформації одиниці об’єму тіла, що подрібнюється; ΔS – нова поверхня, що утворюється в результаті подрібнення.
Фізичний метод – це подрібнення за допомогою ультразвуку. Під час проходження ультразвукових хвиль у подрібнюваній речовині
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.