





2. РАСЧЕТ ГОРЕНИЯ ТОПЛИВА
Цель расчетов горения - найти количественные соотношения между сжигаемым газом, расходуемым на горение воздухом и образующимися продуктами сгорания при условии полного горения. Показатели горения рассчитывают стехиометрическим уравнениям горения компонентов горючей смеси.
Расчет ведут на 1 м3 сухого газа и все объемы относят к нормальным условиям.Расчет выполняется, ориентируясь на длиннофакельное сжигание топлива, осуществляемое, как правило, с коэффициентом избытка воздуха α=1,1 .
Состав природного газа , %:
Метан СН4 98,5
Этан С2Н6 0,797
Пропан С3Н8 0,150
Изобутан С4Н10 0,044
Н.бутан С5Н12 0,053
Изопентан С6Н14 0,011
Н.пентан С2Н4 0,006
Азот N2 0,292
Кислород О2 0,003
Углекислый газ СО2 0,034
Вода Н2О 0,11
---------------------------------------------Итого: 100%
Qрн=127,7CO+108H2+358CH4+590C2H4+555C2H2+636C2H6+913C3H8+
+1185C4H10+1465C5H12+234H2S=358·98,5+590·0,006+636·0,797+913·0,1+
+1185·0,044+1465·0,053=33603,8 кДж/м3 ; (2.1)
2. Расход кислорода на горение [2, c.25] :
Vо2= 0,01×(m + 0,25n)×åСmCn = 0,01×(2СН4 + 3,5С2Н6 + 5С3Н8 + +6,5С4Н10+ 8С5Н12 + 9,5С6Н14 + 3С2Н4) = 0,01×(2×98,5 + 3,5×0,797 +5×0,15+ +6,5×0,044 +8×0,053 + 9,5×0,011 +3×0,006) =2,014 м3/м3 ; (2.2)
3. Расход сухого воздуха при α=1,1 вычисляем по формуле:
Vв = n×(1+k)×Vо2=1,1×(1+3,762) ×2,014=10,550 м3/м3 ; (2.3)
где k = 3,762 – отношение обьемных содержаний N2 и О2 в дутье воздуха),
4. Обьемы отдельных составляющих продуктов сгорания [2,с.25]:
Количество двуокиси углерода, образующееся при полном сгорании
1 м3 газа, зависит только от содержания в нем компонентов, в состав которых входит углерод и от содержания самой двуокиси углерода (в качестве балластной примеси):
Vсо2 = 0,01×(СО2 + måСmCn) = 0,01×(CО2 + СН4 + 2С2Н6 + 3С3Н8 + +4С4Н10 + 5С5Н12 + 6С6Н14 + 2С2Н4)= 0,01×(0,034 + 98,5 + 2×0,797 + 3×0,15 + +4×0,044 +5×0,053 + 6×0,011 + 2×0,006) = 1,011 м3/м3; (2.4)
Количество водяного пара как образующегося при полном сгорании 1 м3 топлива, так и переходящего в продукты сгорания из воздуха и из самого топлива определяется на основании стехиометрического уравнения горения по формуле:
Vн2о = 0,01×(Н2О + 0,5nåСmCn) = 0,01 (Н2О + 2СН4 + 3С2Н6 + 4С3Н8+
+5×0,044 + 6×0,053 + 7×0,011+ 2×0,006) = 2,007 м3/м3 ; (2.5)
Учитывая, что азот, содержащийся как в воздухе, так и в самом топливе в горении участия не принимает и полностью переходит в продукты сгорания, его количество на 1 м3 газа можно определить по формуле:
VNО2 = 0,01 N2 + a×k×Vо2= 0,01×0,292 + 1,1×3,762×2,014 = 8,337 м3/м3 ; (2.6)
Количество кислорода, которое по завершении процесса горения оказывается избыточным и переходит в продукты сгорания, составляет:
Vо2 = (a-1)×Vо2= 0,1×2,014 = 0,201 м3/м3 ; (2.7)
5. Общее количество продуктов сгорания [2, с.25], м3/м3:
åVп.с. = Vсо2 + Vн2о2 + VNО2 + Vо2 = 1,011 + 2,007 + 8,337 + 0,207 = =11,556 м3/м3; (2.8)
6. Процентный состав продуктов сгорания:
rCO2= Vсо2/åVп.с.=(1,011/11,556) ×100=8,748% ; (2.9)
rH2O= Vн2о /åVп.с.=(2.007/11,556) ×100=17,368% ; (2.10)
rNО2= VN2 /åVп.с.=(8.337/11,556) ×100=72,144% ; (2.11)
rO2= Vо2/åVп.с.=(0.201/11,556) ×100=1,739%; (2.12)
7. Правильность расчетов проверяем составлением материального баланса:
Поступило 100 м3 газа: Получено, 11,556 м3 :
СН4 0,985×16=15,76 CO2 1,011×44=44,484
С2Н6 0,079×30=0,2391 H2O 2,007×18=36,126
С3Н8 0,0015×44=0,066 N2 8,337×28=233,436
С4Н10 0,00044×58=0,02552 O2 0,201×32=6,432
С5Н12 0,00053×72=0,03816 ----------------------С6Н14 0,00011×86=0,00946 Итого: 320,478 м3
С2Н4 0,00006×28=0,00168
О2 0,00003×32=0,0096
Н2О 0,0011×18=0,0198
NО2 0,00292×28=0,08176
СО2 0,00034×44=0,01496
------------------------------------Всего: 16,2574 м3;
Воздух: 32×2,21+ 28×8,34=304,24 м3;
------------------------------------Итого: 304,24+16,2574=320,497 м3;
Погрешность материального баланса составляет :
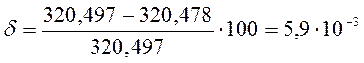 %;
%;
8. Определяем энтальпию воздуха при температуре подогрева tв=400°C:
![]() ; (2.13)
; (2.13)
где ![]() =1,3302
=1,3302 ![]() ·°С
[1, с.345];
·°С
[1, с.345];
9. Определяем энтальпию газа при температуре tг=20°C:
![]()
![]() ; (2.14)
; (2.14)
где ![]() --теплоемкости
компонентов газа [1, с.345];
--теплоемкости
компонентов газа [1, с.345];
10. По формуле [1,с.86] определяем истинную энтальпию продуктов сгорания:
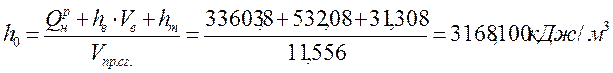 ; (2.15)
; (2.15)
11. Для определения калориметрической температуры воспользуемся методом последовательных приближений:
hi= t`к ×ri × ci ; (2.16)
Принимаем t`к=1900°C:
hCO2= 1900×0,0875×2,4393=405,534 кДж/м3 ;
hH2O= 1900×0,174×1,9252=636,471 кДж/м3;
hNО2= 1900×0,721×1,4780=2024,712 кДж/м3;
h1900=3066,717 кДж/м3;
Принимаем t”к=2000°C:
hCO2= 2000×0,0875×2,4552=429,66 кДж/м3 ;
hH2O= 2000×0,174×1,9449=676,825 кДж/м3 ;
hNО2= 2000×0,721×1,4851=2141,514 кДж/м3 ;
h1900=3247,999 кДж/м3;
Методом интерполяции производим уточнение:
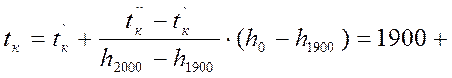
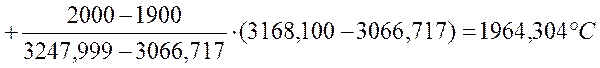 ; (2.17)
; (2.17)
Принимаем ![]() =1964 оС.
=1964 оС.
Для определения
действительной температуры в печи ![]() необходимо
необходимо
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.