Глава Хи
ВТОРОИ ЗАКОН ТЕРМОДИНАМИКИ
5 12.1, Круговые процессы, Цикл Карно
1, Прежде чем переходить к изложению второго закона термодинамики, необходимо рассмотреть круговые процессы. Круговым процессом, или циклом, называют такой процесс, в результате которого термодинамическое тело возвращается в исходное состояние. В диаграммах состояния р — У, р — Т и др. равновесные круговые процессы изображают в виде замкнутых кривых Это связано с тем, что в любой диаграмме двум тождественным состояниям (в рассматриваемом случае — началу и концу кругового процесса) соответству ет одна и та же точка
Круговые процессы лежат в основе всех тепловых машин: двигателей внутреннего сгорания, паровых и газовых турбин, паровых и холодильных машин и т д. Поэтому изучение свойств различных круговых процессов -— одна из важнейших задач физики. Мы ограничимся установлением лишь некоторых общих закономерностей таких процессов
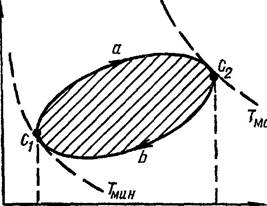 2.
Рассмотрим произвольный равновесный круговой процесс СюС2ЬС, (рис. 12.l),
совершаемый идеальным газом Его можно разбить на два процесса — расширение газа
из состояния С, в состояние
2.
Рассмотрим произвольный равновесный круговой процесс СюС2ЬС, (рис. 12.l),
совершаемый идеальным газом Его можно разбить на два процесса — расширение газа
из состояния С, в состояние ![]() процесс СтаС2) и сжатие
газа из состояния сг в состояние С, (процесс C2bCD. При расширении газ
совершает положительную работу А 1, которая, как показано в S 10 4, измеряется
площадью фигуры V1(haC2V2 на рис 12.l Наоборот, для сжатия газа внешние силы совершают
положительную работу „42 — „42, измеряемую площадью фигуры VC1bC2V2 Из рис. 12
видно, что А 1 ,42'. Потому в целом за цикл газ совершает п о л о ж и т е л ь н
у ю работу А А 1 -1+ „42 А 1 — А ' 2. Она измеряется заштрихованной на рис.
12.1 площадью, ограниченной кривой процесса С,аС2ЬС1. Такой цикл называют
прямым. Если бы ркруговой процесс протекал в обратном направлении (против
часовой стрелки), то суммарная работа, совершаемая газом за цикл, оказалась бы
отрицательной. Численно она также макс измерялась бы площадью С,аС2ЬС1. Такой
цикл называют обратным.
процесс СтаС2) и сжатие
газа из состояния сг в состояние С, (процесс C2bCD. При расширении газ
совершает положительную работу А 1, которая, как показано в S 10 4, измеряется
площадью фигуры V1(haC2V2 на рис 12.l Наоборот, для сжатия газа внешние силы совершают
положительную работу „42 — „42, измеряемую площадью фигуры VC1bC2V2 Из рис. 12
видно, что А 1 ,42'. Потому в целом за цикл газ совершает п о л о ж и т е л ь н
у ю работу А А 1 -1+ „42 А 1 — А ' 2. Она измеряется заштрихованной на рис.
12.1 площадью, ограниченной кривой процесса С,аС2ЬС1. Такой цикл называют
прямым. Если бы ркруговой процесс протекал в обратном направлении (против
часовой стрелки), то суммарная работа, совершаемая газом за цикл, оказалась бы
отрицательной. Численно она также макс измерялась бы площадью С,аС2ЬС1. Такой
цикл называют обратным.
З. В S 10.1 было показано, что внутренняя энергия тела зависит только от Рис. 12.1. его состояния. Поэтому полное изменение внутренней энергии газа в результате кругового процесса равно нулю. Следовательно, по первому закону термодинамики имеем:
![]()
где Q — общее количество теплоты, сообщенной газу в круговом процессе, А — работа газа в этом процессе.
 В
прямом цикле А > 0 и Q > 0, т. е. в прямом цикле газ совершает работу за
счет сообщенной ему теплоты. Наоборот, в обратном цикле н а д г а з о м
совершается работа А ' — А (А < 0) и от него отводится эквивалентное ей
количество р теплоты. В тепловом двигателе рабочее тело [1]
совершает прямой цикл, а в холодильной машине — обратный цикл.
В
прямом цикле А > 0 и Q > 0, т. е. в прямом цикле газ совершает работу за
счет сообщенной ему теплоты. Наоборот, в обратном цикле н а д г а з о м
совершается работа А ' — А (А < 0) и от него отводится эквивалентное ей
количество р теплоты. В тепловом двигателе рабочее тело [1]
совершает прямой цикл, а в холодильной машине — обратный цикл.
![]() 4.
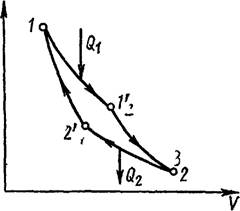
В качестве примера кругЬвого процесса рассмотрим цикл С. Карно. Этот цикл
сыграл огромную роль в развитии термодинамики и теплотехники, так как позволил
подойти к анализу коэффициентов полезного действия тепловых ма. 0 шин Циклом
Карно называют круговой процесс, состоящий из двух Рис. 12.2. изотерм и двух
адиабат. На рис.
4.
В качестве примера кругЬвого процесса рассмотрим цикл С. Карно. Этот цикл
сыграл огромную роль в развитии термодинамики и теплотехники, так как позволил
подойти к анализу коэффициентов полезного действия тепловых ма. 0 шин Циклом
Карно называют круговой процесс, состоящий из двух Рис. 12.2. изотерм и двух
адиабат. На рис.
12.2 изображен прямой цикл Карно, состоящий из следующих четырех последовательных процессов:
1—1' — изотермическое
расширение при температуре Т1(Тк![]()
1'—-2 — адиабатическое расширение,
2—2' — изотермическое сжатие при
температуре Т„(Ту = Т 2), ![]() адиабатическое сжатие.
адиабатическое сжатие.
Практическое осуществление цикла Карно можно представить себе следующим образом. Некоторое количество газа заключено в цилиндре с подвижным поршнем. В процессе изотермического расширения 1—1' газ находится в тепловом контакте и равновесии с телом, имеющим температуру Т 1. Таким телом может служить, например, большой резервуар с водой. Это тело называют нагревателем. В процессе 1—1' оно передает газу теплоту Ql(Qf >O). Ясно, что теплоемкость нагревателя должна быть, строго говоря, бесконечно большой. В противном случае отдача газу теплоты Q1 вызвала бы понижение температуры нагревателя, а следовательно, и нарушение изотермичности процесса расширения газа. В процессе 1'—2 газ полностью теплоизолируют и его расширение продолжает происходить адиабатически. Это означает, что на участке 1'—2 газ разобщают с нагревателем
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.