|
Лабораторная работа № 7
Химическое
равновесие
Цель работы: определить параметры
химического равновесия гомогенной реакции.
Задание
- Определить
равновесные концентрации веществ в ходе реакции хлорида железа (III) с иодидом калия.
- Рассчитать
значение константы равновесия вышеуказанной реакции при заданной
температуре.
- Используя
значения константы вышеуказанной реакции для нескольких температур,
рассчитать тепловой эффект реакции.
Приборы и материалы
Водяной или воздушный термостат. Конические колбы с притертыми
пробками на 100 мл (6 шт.), конические колбы на 100 мл для титрования (6
шт.), бюретка на 25 мл, пипетки на 5, 10 и 25 мл, мерный цилиндр на 100 мл.
Растворы FeCl3 – 0,03
M; KJ – 0,03
M; Na2S2O3 – 0,015
М; дистиллированная вода и лед.
Теоретическая часть
Все химические реакции делятся на практически необратимые,
например:
BaCl2
+ Na2SO4 ®
BaSO4¯ +
2NaCl
CaCO3
® CaO + CO2,
и обратимые, например:
N2
+ 3H2 «
2NH3
FeO + H2
«Fe + H2O
Обратимые процессы характеризуются как прямой (®), так и обратной
(¬)
реакции. Согласно закону действующих масс, скорость прямо пропорциональна
произведению концентраций реагирующих веществ в степенях, равных, как
правило, стехиометрическим коэффициентам.
Рассмотрим гомогенную реакцию вида:
аА + вВ = сС + dD, где А и В –
исходные вещества,
С и D – продукты реакции, а, в, с, d – соответствующие стехиометрические
коэффициенты.
В процессе реакции скорость прямой реакции
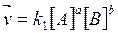 (1)
(1)
Уменьшается, а обратной 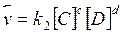 (2) (2)
возрастает.
В этих выражениях [ ] – символ концентрации вещества, k – константа химической скорости реакции.
Когда обе скорости сравняются, наступает состояние химического
равновесия – число молекул веществ, составляющих химическую систему,
перестает меняться и остается постоянным во времени при неизменных внешних
условиях. Таким образом, химическое равновесие является динамическим и
подвижным – с изменением внешних условий равновесие сдвигается в одну или в
другую сторону и возвращается к исходному состоянию, если внешние условия
достигает первоначальных значений.
Бесконечно малое изменение внешних условий влечет за собой также
бесконечно малое изменение состояния равновесия. Следовательно, химические
реакции могут протекать как термодинамически равновесные процессы, т.е. к
ним можно применить общие условия термодинамического равновесия.
Из условия 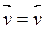 , учитывая
(1) и (2), можно записать: , учитывая
(1) и (2), можно записать:
k1[A]a[B]b
= k2[C]c[D]d или 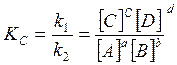 (3) (3)
где КС
– константа химического равновесия.
В точных расчетах вместо концентраций используются значения активностей.
Равновесие подвижно, но характеризуется постоянством состава. Для
данной реакции КС зависит только от температуры и связана с
изменением стандартной энергии Гиббса DG° уравнением изотермы Вант – Гоффа:
- DG° = RT × ln × Kp (4)
Химическая термодинамика позволяет, не проводя процесс, рассчитать
величину константы равновесия и оценить выход продуктов реакции.
При изменении внешних условий (температуры, концентрации, давления)
состояние равновесия нарушается. Согласно принципу Ле Шателье, если на
химическую систему, находящуюся в равновесии, оказать какое-либо воздействие,
то в системе усиливаются те процессы, которые стремятся свести это действие
к минимуму.
Например, при нагревании равновесной системы, равновесие смещается
в сторону эндотермической реакции, при охлаждении – в сторону экзотермической
реакции. Повышение давления сдвигает равновесие в сторону меньших объемов,
а понижение – в сторону больших объемов.
Зависимость константы равновесия от температуры при постоянном
давлении определяется уравнением изобары (Р=const).
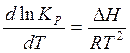 (5) (5)
и изохоры (V = const)
Вант – Гоффа.
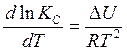 (6) (6)
где DН и DU – выражения тепловых эффектов соответствующих процессов.
В интегральной форме уравнение изобары имеет вид:
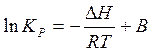 (7) (7)
где В – постоянная интегрирования.
Проанализируем уравнение изобары на примере реакции синтеза
аммиака: 3Н2 + N2 Û 2NH3 , учитывая, что прямая реакция является экзотермической, а
обратная, следовательно, эндотермической.
В экзотермической реакции система теряет тепло и DН < 0, в
соответствии с выражением (5) 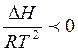 и и
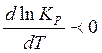 , следовательно, при
увеличении температуры (dT >
0) константа равновесия будет уменьшаться (d×ln×R0 < 0), т.е. при повышении температуры
равновесие будет смещаться влево, в сторону обратной эндотермической
реакции. , следовательно, при
увеличении температуры (dT >
0) константа равновесия будет уменьшаться (d×ln×R0 < 0), т.е. при повышении температуры
равновесие будет смещаться влево, в сторону обратной эндотермической
реакции.
Если же прямая реакция является эндотермической |