|
х |
АРАКТЕРИСТИЧЕСКИЕ свойства керамики определяются ее
структурой как на атомном уровне, так и в масштабах от нескольких микрометров
(миллионных долей метра) до миллиметров. В атомной структуре керамических
материалов встречаются два типа связей — ионная и ковалентная. При ионной связи
электроны переходят от одного атома к другому, в результате чего атом, отдав![]() ший
электрон, становится положительно заряженным, а атом, захватывающий электрон,
приобретает отрицательный заряд. Электростатические силы, действующие между
разноименными зарядами, связывают атомы между собой.
ший
электрон, становится положительно заряженным, а атом, захватывающий электрон,
приобретает отрицательный заряд. Электростатические силы, действующие между
разноименными зарядами, связывают атомы между собой.
При ковалентной связи валентные (внешние) электроны более или менее
 |
НАУКИ-1986/№
![]()
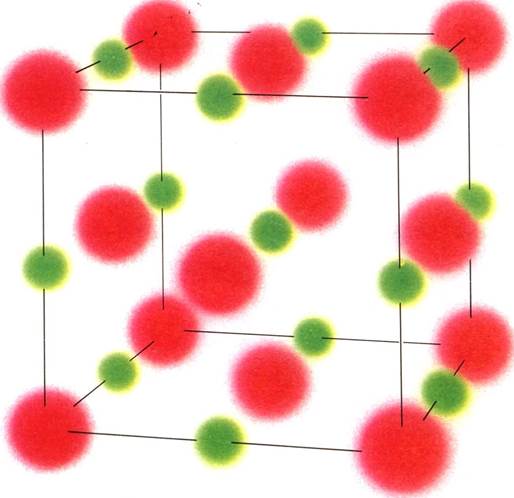
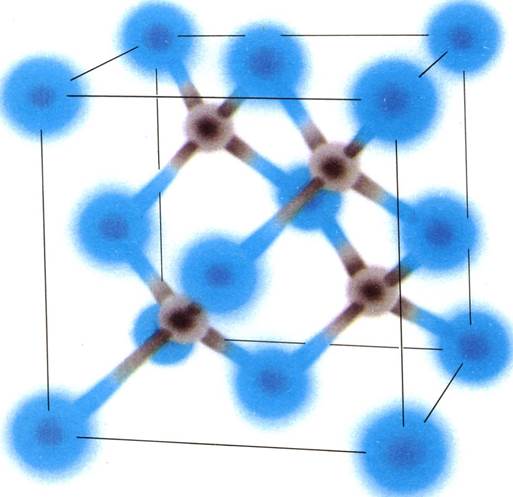
ХИМИЧЕСКИЕ СВЯЗИ В КЕРАМИЧЕСКИХ МАТЕРИАЛАХ могут быть как ионные (вверху), так и ковалентные (внизу). При ионной связи электрон одного атома переходит к соседнему атому: атом-донор приобретает положительный, а атомакцептор — отрицательный заряд. Электростатическая сила, возникающая между атомами, удерживает их на местах. При ковалентной связи электроны поделены между соседними атомами. В отличие от ионных-ковалентные связи характеризуются четкой направленностью и не позволяют атомным плоскостям смещаться относительно друг друга.
равномерно поделены между соседними атомами. Несмотря на то что силы электростатического притяжения в этом случае слабее, чем при ионной связи, ковалентная связь фиксирует взаимное расположение атомов, так как слабое электростатическое взаимодействие компенсируется сильной направленностью ковалентной связи. Самый твердый из известных материалов — алмаз — состоит из атомов углерода, соединенных именно ковалентными связями.
Группы атомов, связанные ионными или ковалентными связями, образуют так называемые элементарные ячейки, которые могут периодически повторяться по всему объему материала. Такое упорядоченное расположение элементарных ячеек соответствует кристаллической структуре. Если вне пределов локальной элементарной ячейки периодичность отсутствует, то материал считают некристаллическим. Во многих случаях одна и та же комбинация атомов может давать как кристаллическую, так и некристаллическую структуру. Это зависит от того, хватает ли времени у атомов выстроиться в упорядоченную структуру в процессе формирования материала. Например, если расплавить кварц (диоксид кремния Si02) и затем охлаждать его достаточно медленно, то молекулы выстраиваются в кристаллическую решетку, имеющую дальний порядок, и образуют кристалл кристобаллита (модификация диоксида кремния). Однако если тот же расплав охлаждать быстро, то молекулы не успевают выстроиться в решетку и оказываются «замороженными» в нерегулярной структуре, образуя некристаллическое вещество — силикатное стекло.
Именно атомной структурой керамика отличается от других материалов. Для керамики типичны сильные гибридные ионно-ковалентные связи, ограничивающие движение электронов, тогда как в металлах атомы образуют решетку, что обеспечивает свободное движение их валентных электронов. Молекулы органических веществ, состоящие в основном из атомов углерода и водорода, чаще всего образуют полимеры, т. е. длинные цепи, а не трехмерные кристаллические структуры.
Благодаря разнообразию атомных структур (существует 14 классов элементарных ячеек), а также способности многих элементов замещать друг друга возможности получения керамических материалов с разнообразными свойствами кажутся безграничными. Приведем один пример — ОКсид алюминия (окись алюминия A1203). Если в монокристалл оксида алюминия ввести атомы хрома, то
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.