ЕРВЫЕ ШАГИ на пути к реально-нему под давлением подводят опреде- микроскоп для
 сле
того, как американский химик Чарлз Мартин Холл разработал экоНОМИЧеСКИ
рентабельный метод получения металлического алюминия, осНОВаННЫЙ на пропускании
электрического тока через расплавленный криолит — фтористое соединение,
содержащее натрий и алюминий. В последующие несколько десятилетий были
разработаны важные процессы, которые позволили получать высокоуглеродистую,
кремнистую и нержавеющую стали.
сле
того, как американский химик Чарлз Мартин Холл разработал экоНОМИЧеСКИ
рентабельный метод получения металлического алюминия, осНОВаННЫЙ на пропускании
электрического тока через расплавленный криолит — фтористое соединение,
содержащее натрий и алюминий. В последующие несколько десятилетий были
разработаны важные процессы, которые позволили получать высокоуглеродистую,
кремнистую и нержавеющую стали.
Но только в ХХ столетии, и особенно в последние 40 лет,
химикам и физикам удалось сделать ряд фундаментальных открытий, на которые
опираются все современные разработки новых материалов и технологические методы
их получения и обработки. Более глубокое теоретическое понимание природы
материалов и наличие совершенных аналитических прибо![]() ров для их изучения обусловили тесное
сотрудничество ученых и инженеров.
ров для их изучения обусловили тесное
сотрудничество ученых и инженеров.![]()
Основной вклад науки в рассматри![]() ваемую область
состоял в том, что ей удалось установить взаимосвязь меж
ваемую область
состоял в том, что ей удалось установить взаимосвязь меж![]() ду внешне
проявляющимися свойствами материалов и их внутренним строением. Как было
установлено, материалам свойственна определенная внутренняя архитектура, иными
словами, иерархическая последовательность структурных уровней. Эта архитектура
представлялась довольно сложной, так как она должна была объяснять все
многообразие проявляемых материалами свойств. Признание этого факта в свою
очередь предполагало, что поведение того или
ду внешне
проявляющимися свойствами материалов и их внутренним строением. Как было
установлено, материалам свойственна определенная внутренняя архитектура, иными
словами, иерархическая последовательность структурных уровней. Эта архитектура
представлялась довольно сложной, так как она должна была объяснять все
многообразие проявляемых материалами свойств. Признание этого факта в свою
очередь предполагало, что поведение того или
|
ТЕОРИЯ АТОМНОГО СТРОЕН ИЯ ВЕЩЕСТВА была обогащена трудами Дж. дальтона в начале XlX в. На рисунке изображена таблица, которую Дальтон демонстрировал во время своих лекций. На ней символами обозначены «элементы или атомы», которые он считал неделимыми. Атомные веса даны в весах атома водорода (которому приписано значение 1). |
иного материала можно предсказать заранее, если тщательно изучить его внутреннюю архитектуру. Такому изучению способствует большой выбор новых приборов и методов, которые позволяют все глубже и глубже проникать в природу ма- |
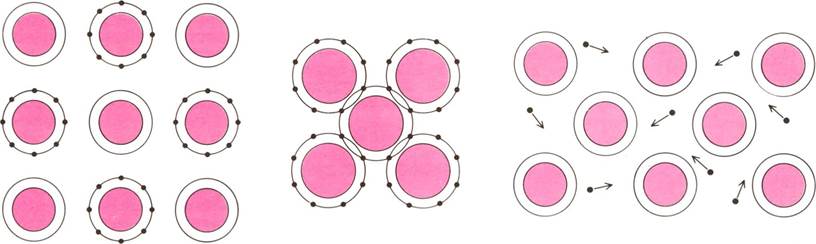
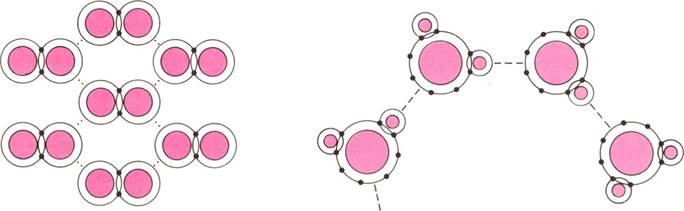
ИОННАЯ СВЯЗЬ КОВАЛЕНТНАЯ СВЯЗЬ МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
|
ХИМИЧЕСКИЕ СВЯЗИ, зависящие от электронной структуры материала, непосредственно определяют его свойства. Представленные здесь пять видов связи изображены весьма условно; для большинства материалов характерна комбинация различных видов связи. Ионная связь образуется между ионами — положительно или отрицательно заряженными атомами: противоположно заряженные ионы притягиваются друг к другу. При ковалентной связи пары |
металлах все электроны на внешних оболочках являются общими для всех атомов; они свободно передвигаются в кристаллической решетке, благодаря чему металлы являются хорошими проводниками электрического тока. Вандерваальсова связь характеризуется слабым взаимным притяжением соседних нейтральных атомов или молекул. Слабая водородная связь образуется благодаря наличию общего для двух молекул атома водорода. |
атомов имеют общие электроны на внешних оболочках. В
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.