17. Роль экзотермической реакции, протекающей в абсорбционной колонне азотнокислотного производства. Тепловой баланс.
Оксиды азота взаимодействуют с водой по следующим реак-ям: 2NO2(г)+H2O(ж)=НNO3(р)+HNO2(р) DН=-116кДж; N2O4(г)+H2O(ж)=НNO3(р)+HNO2(р) DН=-159кДж; N2O3(г)+H2O(ж)=2HNO2(р) DН=-56кДж; Приведенные реакции протекают с высокой скоростью, HNO2 неустойчива и разлагается: 3HNO2(р)=НNO3(р)+2NO+H2O, DН=75,8кДж. Суммарная реак-я образования к-ты складывается из выше приведенных ур-й и имеет вид: 3NO2+H2O=2HNO3+NO DH=-136,2кДж Т.о. 1/3 NO возвращается в газовую фазу в виде вторичного оксида азота 2. В межтарельчатом пространстве протекает реакция 2NO+O2=2NO2 DH=-114кДж. Следовательно, для переработки оксидов азота в к-ту необходимо понижать темп-ру, а для разложения азотистой к-ты наоборот повышать ее. Для поддержания оптимального температурного режима проведения процесса абсорбции предусмотрены встроенные в колонну расположенные на тарелках теплообменники, с помощью которых отводится избыточное тепло вышеприведенных экзотермических реакций и тепло разбавления азотной к-ты.
Уравнение тепл. баланса имеет вид Q1+Q2+Q3+Q4+Q5=Q6+Q7+Q8+Q9 где Q1-физ. теп. нитрозного газа на входе в колонну (под тарелкой №1); Q2- тепло реакции гомогенного окисления NO до NO2; Q3-тепло р-ии образования НNO3 на тарелке; Q4-тепло разбавления образовавшегося моногидрата от 100% до 58%масс; Q5-физ-е тепло р-ра НNO3 поступающего на тарелку №1 с тарелки №2. Расход Q6-физ-е тепло нитрозного газа на выходе из тарелки №1. Q7-физ-е тепло р-ра НNO3 покидающего тарелку №1; Q8-избыточное тепло передаваемое оборотной воде; Q9-потери тепла в окр среду.
Цели расчета теплового баланса: Расчет всех потоков тепла, расчет расхода оборотной воды подаваемой в змеевики тарелки и поверхности змеевиков.
Величины
Q1,Q5,Q6,Q7-вычисляются по формуле Q=nct,
где n-кол-во в-ва(потока), кмоль; c- средняя мольная
теплоемкость потока при t, кДж/моль К ; t-температура
потока оС. Теплоемкость смеси вычисляется по закону аддитивности,
используя справочные данные по средним мольным теплоемкостям веществ входящих в
смесь либо вычислить по эмпирическим зависимостям с=f(t). Q2,Q3,Q4
-Теплоты реакции, разбавления вычисляются по формуле Q=nq
где n-кол-во прореагировавшего в-ва, кмоль; q-
мольная теплота реакции либо мольная теплота разбавления, кДж/моль; Q9-потери
тепла в окруж-ю среду принимают равными в размере 0,4% от прихода тепла; Q8-вычисляют
из равенства приходной и расходной частей баланса. Расчет расхода оборотной
воды проводят из соотношения Q8=Gвсв(tk-tн) где Gв
–масса воды, св –теплоемкость
воды, 4,187кДж/(кг*К), tн,tk –температуры соответственно начальная и конечная; Требуемая
поверхность змеевиков на тарелке определяется из уравнения теплопередачи Q=KFDt. Необходимо сделать 20% запас поверхности.
Коэффициент теплопередачи, 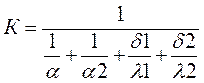 где a1-коэффициент теплоотдачи от к-ты к стенке, Вт/м2К; a2-коэф теплоотдачи от стенки к воде, Вт/м2К; d1-толщина стенки трубки, м; d2-толщина накипи на
стенке трубки, принимается равной 0,0005 м; l1- коэф теплопроводности материала трубок, Вт/мК; l1- коэф теплопроводности накипи, Вт/мК. Коэффициенты теплоотдачи и
теплопроводности рассчитываются, или принимаются на основе справочных данных.
где a1-коэффициент теплоотдачи от к-ты к стенке, Вт/м2К; a2-коэф теплоотдачи от стенки к воде, Вт/м2К; d1-толщина стенки трубки, м; d2-толщина накипи на
стенке трубки, принимается равной 0,0005 м; l1- коэф теплопроводности материала трубок, Вт/мК; l1- коэф теплопроводности накипи, Вт/мК. Коэффициенты теплоотдачи и
теплопроводности рассчитываются, или принимаются на основе справочных данных.
46.Интенсификация процесса абсорбции и способы её увеличения.
3NO2 (г) + Н2О (ж) Û NO (г) + 2НNO3 (ж). Н<0
Методы интенсификации процессов абсорбции зависят, в частности, от того, в какой области, диффузионной или кинетической, идет процесс. Если абсорбция протекает в кинетической области, т. е. сопровождается химическими реакциями, скорость которых меньше скоростей диффузии, то основными методами интенсификации являются обычные приемы увеличения скорости химических реакций: повышение температуры, концентрации реагентов, давления, а также и применение катализаторов. Для ускорения абсорбционных процессов в диффузионной и переходной областях применяют иные методы в соответствии с иным характером движущей силы и коэффициента скорости процесса. Основными методами интенсификации этих процессов являются: 1) максимальное развитие поверхности контакта фаз; 2) турбулизация и интенсивное перемешивание потоков жидкости и газа для увеличения коэффициента массопередачи; 3) понижение температуры для уменьшения р* (и рi*) и соответственного увеличения движущей силы DС; 4) повышение начальной концентрации поглощаемого компонента в газе или увеличение общего давления.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.