Новосибирский государственный университет
Факультет естественных наук
Лабораторная работа по кинетике.
Нахождение истинной константы скорости реакции йодирования ацетона
и константы протонирования ацетона.
Студентов III курса ФЕН
Новосибирск 2009
Теоретическая часть
Для изучения кинетики йодирования ацетона был применен спектрофотометрический метод. Сам ацетон не имеет поглощения в видимой области и ближнем ультрафиолете, его иодид тоже, а вот сам йод имеет 2 полосы поглощения 350, 420 нм. Следовательно по убыли йода мы можем наблюдать кинетику реакции йодирования ацетона.
CH3COCH3 + I2 ® CH2COCH2I + HI
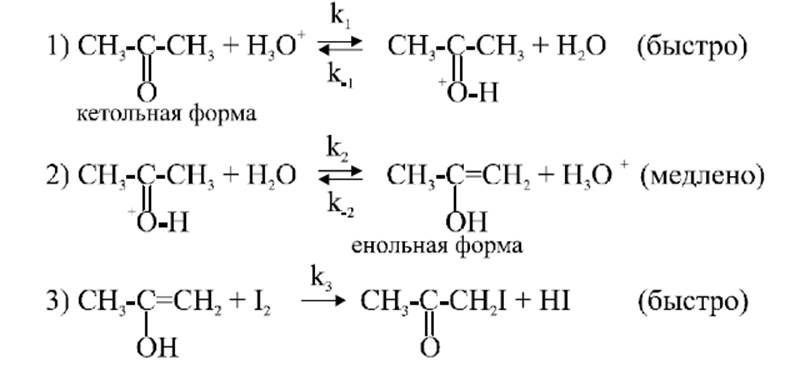
Первая цель данной нашей работы как раз найти константу скорости второго процесса, ведь именно она является лимитирующей. Одновременно с этим метод позволяет вычислить косвенным методом константу равновесия между протонированной и депротонированной форм ацетона в растворе, используя следующие формулы:
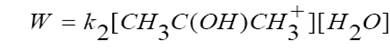
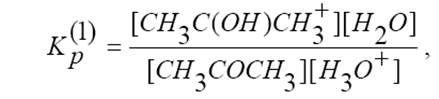
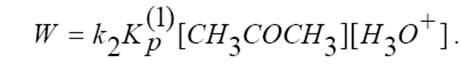
Последняя формула как раз позволяет нам связать скорость реакции с концентрацией ацетона, начальную количество которого мы хорошо знаем, а изменение его во времени тождественно соответствуют убыли йода, который мы легко можем фиксировать. Для удобства вводим эффективную константу:
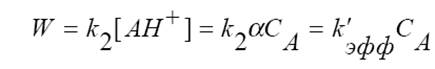 , где a – степень диссоциации,
, где a – степень диссоциации,
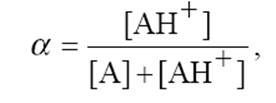
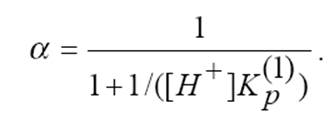
Вводится константа эффективная:
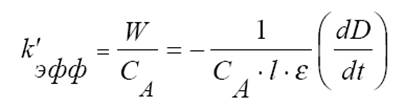 где l - толщина кюветы,
а ε - коэффициент экстинции йода на данной длине волны.
где l - толщина кюветы,
а ε - коэффициент экстинции йода на данной длине волны.
А для удобства расчетов и обработки экспериментальных данным преобразуем зависимость для Kэф к следующему виду.
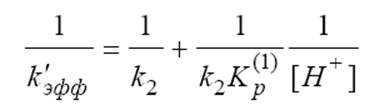
В принципе всего этого достаточно для проведения экспериментов и расчетов.
Экспериментальная часть
Ход работы:
1. Приготовили растворы йода и сняли их оптическую плотность:
|
С моль\л |
D |
|
1E -5 |
0,16054 |
|
2,5E- 5 |
0,49065 |
|
5E -5 |
1,1239 |
|
1E -4 |
2,4287 |
По этим точкам был построен график и вычислен коэффициент экстинкции:
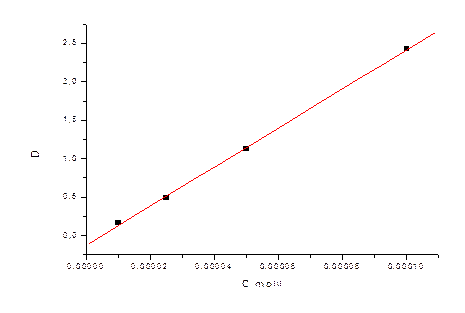
Из графика D = -0.123 + 25384*C, отсюда
ε = 25384/0.7 = 36263 (толщина кюветы 0.7 см).
2.
Провели кинетические измерения с растворами,
содержацими 7.5E-5 моль\л йода, 0.1 моль\л ацетона и разными
концентрациями соляной кислоты, по показанием первой минуты работы прибора были
посчитаны величины ![]() (на примере оптыа с 0.05 М кислотой):
(на примере оптыа с 0.05 М кислотой):
|
Время,с |
D |
|
|
1.4 |
1.80 |
-0.00112 |
|
12 |
1.79 |
-0.00081 |
|
22 |
1.78 |
-0.00123 |
|
32 |
1.77 |
-0.00107 |
|
42 |
1.76 |
-0.00094 |
|
52 |
1.75 |
-0.00138 |
|
62 |
1.73 |
-0.00088 |
|
|
-0,00109 |
|
Аналогичным
образом посчитаны и остальные опыты, данные внесены в таблицу(для расчета Kэф использовали
формулу -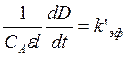 ):
):
|
С HCl, моль\л |
|
Kэф |
1\ Kэф |
1\ С HCl |
|
0.05 |
-0.00109 |
4.294E-07 |
2328807 |
20.0 |
|
0.07 |
-0.00207 |
8.155E-07 |
1226280 |
14.3 |
|
0.09 |
-0.00299 |
1.178E-06 |
848963 |
11.1 |
|
0.1 |
-0.00346 |
1.363E-06 |
733642 |
10.0 |
|
0.12 |
-0.00389 |
1.532E-06 |
652545 |
8.3 |
|
0.13 |
-0.00444 |
1.749E-06 |
571712 |
7.7 |
|
0.14 |
-0.00455 |
1.792E-06 |
557890 |
7.1 |
3. Построили по этим данным график в координатах: 1\ Kэф - 1\ С HCl :
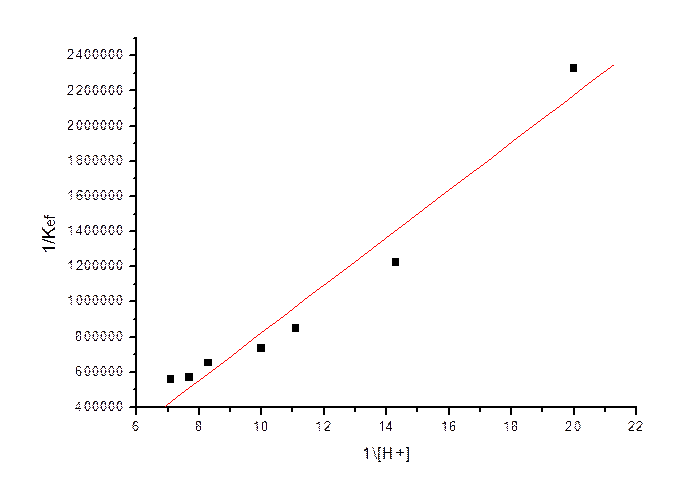
Уравнение прямой получилось в виде 529330 + 135352.2*x.
Следовательно
имея уравнение: 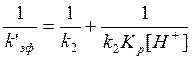 , Значение 529330 соответствует
, Значение 529330 соответствует ![]() , а 135352.2
соответствует 1/
, а 135352.2
соответствует 1/![]() . Отсюда
легко вычислить, что:
. Отсюда
легко вычислить, что:
![]() = 1.89 E-6, a
= 1.89 E-6, a ![]() = 3.91
= 3.91
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.