


Министерство образования РФ
Владимирский Государственный Университет
Кафедра экологии
Лабораторная работа №1.
Определение рН кислотных осадков
Выполнил студент
Приняла
Владимир, 2002 г.
Цель работы: научиться определять кислотность атмосферных осадков.
Оборудование: мерный цилиндр емкостью 250 мл, тест-системы для определения рН природных вод и атмосферных осадков.
Кислотными называются любые осадки, кислотность которых выше нормальной. Это осадки с рН 5.5 и ниже. Они обусловлены присутствием серной H2SO4 и азотной HNO3 кислот. Присутствие в формулах серы и азота указывает на то, что проблема связана с выбросом этих элементов в воздух.
Наиболее распространенными соединениями серы, поступающими в атмосферу, являются диоксид серы SO2, сульфаты SO4, сероуглерод CS2 и сероводород H2S. Они попадают в атмосферу как естественным путем, так и в результате антропогенной деятельности. В последнем случае сера попадает в атмосферу в виде своего диоксида, его основным источником является уголь. Металлургическая промышленность – источник SO2. Однако основной вред окружающей среде наносит не диоксид серы, а продукт его окисления – SO3. Он растворяется в капельках воды с образованием серной кислоты:
SO3+H2O=H2SO4
Загрязнение атмосферы оксидами азота сравнительно невелико, но в районах с развитой химической промышленностью в воздухе повышено содержание NO и NO2. Оксиды азота поступают в воздух при сжигании всех видов природного топлива. Монооксид азота NO образуется в ДВС при прямом взаимодействии кислорода с азотом, на 1 км пробега его выделяется 1-2 грамма. NO, в свою очередь может реагировать с кислородом:
2NO+O2=2NO2
Образуется диоксид азота, растворяющийся в воде:
3NO2+H2O=2HNO3+NO
Указанные вещества выпадают на землю вместе с осадками, которые становятся кислотными. Их рН зависит от количества как кислот, так и воды.
Влияние кислотных осадков на экосистемы осуществляется различными путями:
1. Влияние на водные экосистемы. Здесь значение рН среды чрезвычайно важно, поскольку от него зависит деятельность всего организма. В пресноводных озерах рН, обычно, составляет 6-7, при его изменении всего на единицу организмы испытывают стресс и часто погибают. Случается это не столько из-за прямого действия ионов Н+, сколько из-за невозможности размножения. В дополнение ко всему кислотные осадки растворяют алюминий и тяжелые металлы, которые попадают в воду и вызывают аномалии развития эмбрионов рыб.
2. Влияние на леса. Кислоты нарушают защитный восковой покров листьев, делая растения уязвимыми для паразитов. Пониженный рН увеличивает выщелачивание биогенов, а значит, замедляется рост деревьев, они становятся уязвимыми для врагов и засух. Сказывается также чувствительность многих растений к алюминию, который высвобождается по указанной выше причине.
3. Снижение буферной емкости. Защитить систему от изменения рН может буфер. Это вещество, способное поглощать или высвобождать ионы водорода при данном уровне рН. В качестве буфера в водоемах и почвах содержится известняк CaCO3. Реагируя с кислотой, известь попросту расходуется, поэтому можно говорить о буферной емкости системы.
4. Влияние на людей и изделия. Одно из наиболее ощутимых последствий кислотных осадков – разрушение произведений искусства из известняка и мрамора. Также ускоренно коррозируют металлоконструкции, нарушается целостность лакокрасочных покрытий. Повышенное содержание алюминия вызывает болезнь Альцгеймера.
Результаты экспериментов.
Измерение кислотности производилось 3 раза. рН вычислялся на основе количества щелочи, потребовавшегося для нейтрализации 25 мл осадков:
VщСщ=Ск.осVк.ос
рН=-lg(Ск.ос)
Таблица 1. Количество израсходованной щелочи.
|
№ |
1 |
2 |
3 |
|
|
Vщ, мл |
8.3 |
8 |
8 |
8.1 |
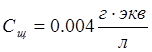
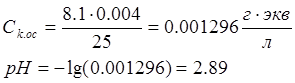
Вывод.
рН у исследованного образца чрезвычайно низкий, почти в два раза меньше нормы. Этот факт говорит о том, что в местности, где была взята проба, развита промышленность, а экологическим проблемам уделяется крайне мало внимания. Между тем, повышенная кислотность крайне отрицательно сказывается как на здоровье человека, так и на состоянии окружающей среды в целом.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.