Министерство образования и науки РФ
Государственное образовательное учреждение
высшего профессионального образования
Владимирский государственный университет
Факультет Химии и Экологии
Кафедра Химии
Отчет
Определение эквивалентной массы металла
Выполнил: студент гр. РТ – 109
Проверила:
Владимир 2010 г.
1. Цель работы:
Определить эквивалентную массу металла используя метод основанный на измерении объема водорода, который выделяется из кислоты при действии на неё металла.
2. Теоретическое введение:
Моль – количество вещества, в котором содержится 6, 02∙1023 частиц (число Авогадро). Масса одного моля вещества называется мольной массой. Мольная масса выражается в граммах на моль и численно равна сумме мольных масс элементов, входящих в состав вещества. Эквивалентом элемента называют такое его количество, которое соединяется с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса одного эквивалента элемента называется его эквивалентной массой. Эквивалентная масса элемента (Э) определяется отношением мольной массы элемента (М) к его валентности (В), которую он проявляет, образуя соединение: Э = М/В. Эквивалент и эквивалентная масса – величины переменные, они зависят от характера реакции, в которой данное вещество принимает участие. Эквивалент водорода равен 1 (эквивалентная масса водорода 1 г.). Эквивалент кислорода равен 8 (эквивалентная масса кислорода 8 г.). При нормальных условиях эквивалентная масса водорода занимает объем 11,2 л, а кислорода – 5,6 л (эквивалентные объемы). Эквивалентом сложного вещества называют такое его количество, которое взаимодействует без остатка с одним эквивалентом любого вещества. Эквивалентная масса соединения определяется следующим образом:
А) Эквивалентная масса кислоты Эк равна ее мольной массе Мк , деленной на основность кислоты n (число атомов водорода в кислоте), Эк = Мк /nн .
Б) Эквивалентная масса основания Эо равна ее мольной массе Мо , деленной на валентность металла Вме , образующего основание, Эо = Мо / Вме .
В) Эквивалентная масса соли Эс равна ее мольной массе Мс , деленной на произведение валентности металла Вме , на число его атомов в молекуле nме ,
Эс = Мс / Вме ∙ nме . Закон эквивалентов: вещества в химических реакциях взаимодействуют друг с другом в эквивалентных количествах. Математически закон эквивалентов выглядит следующим образом: m1 /Э1 = m2 /Э2 , где m1 и m2 – массы реагирующих веществ, Э1 и Э2 – их эквиваленты. Если в реакциях участвуют газы:
V1 /Vэ1 = V2 /Vэ2 , где V1 и V2 объемы веществ вступающих в реакцию, Vэ1 и Vэ2 их эквивалентные объемы. Нормальные условия po = 760 мм рт. ст., t = 273 К. Если одно из реагирующих веществ находится в твердом состоянии, а второе – в газообразном, то закон эквивалентов можно выразить формулой: x/Э = Vo /Voэ .
3.Выполнение работы:
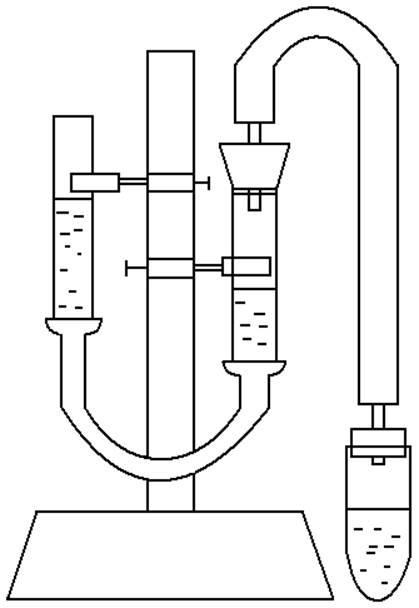
Метод основан на измерении объема водорода, который выделяется из кислоты при действии на нее металла. Применяемый для этой цели прибор состоит из двух бюреток , укрепленных на штативе и соединенных резиновой трубкой. В такой сообщающийся сосуд наливают воду приблизительно до половины бюреток. Одну из бюреток сверху закрывают пробкой с отводной трубкой, к которой присоединяют пробирку, где происходит реакция между кислотой и металлом. Другая бюретка служит приемником для воды, вытесняемой выделяющимся при реакции водородом. В пробирку налить соляной кислоты, поместить навеску металла на стенку у отверстия пробирки и закрыть пробкой с отводной трубкой. Привести воду в бюретках к одинаковому уровню. Стряхнуть металл в кислоту. Наблюдать выделение водорода и вытеснение воды из бюретки. По окончании реакции дать пробирке охладиться на воздухе, после чего снова привести воду в бюретках к одинаковому уровню.
Обработка экспериментальных данных
По полученным данным рассчитать:
1) Объем выделившегося водорода.
2) Объем водорода при н.у.
3) Теоретическое значение эквивалентной массы Mg, Al, Fe, Zn.
4) Опытное значение эквивалентной массы металла.
5) Относительная ошибка опыта.
Формулы парциального давления и относительной погрешности опыта:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.