Цель: вычислить изменения энтропии тел при необратимых процессах.
Приборы и принадлежности: калориметр, калориметрические тела, горячая и холодная вода, водомерный стакан, термометр.
Ход работы:
Изменение энтропии системы найдем по формуле:
![]()
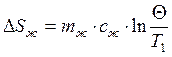
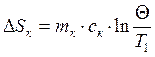
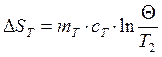
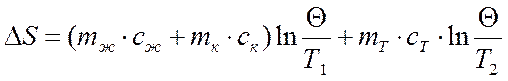
Где: ΔSж/к/Т – изменение энтропии жидкости/калориметра/тела.
Θ – установившаяся температура равновесия.
Т1 – абсолютная температура жидкости и калориметра.
Т2 – абсолютная температура нагретого тела.
m – масса объекта, c – его удельная теплоемкость.
Опытные данные:
Т1=290К; Т2=373К; mk=41∙10-3кг; ck=896 Дж/(кг∙К); mж=200∙10-3кг; cж=4180Дж/(кг∙К);
1) Железное тело:
mТ=152∙10-3 кг; cТ=460 Дж/(кг∙К); Θ=297К
ΔS=4.885 Дж/К
2) Алюминиевое тело:
mТ=53.1∙10-3кг; сТ=896 Дж/(кг∙К); Θ=295К
ΔS=9.975 Дж/К
3) Латунное тело:
mТ=164∙10-3кг; сТ=386 Дж/(кг∙К); Θ=298К
ΔS=6.392 Дж/К
Вывод: в ходе лабораторной работы мы провели опыты и измерили изменение энтропии для трех тел. Анализ результатов показывает, что в нашем опыте энтропия в ходе необратимого процесса увеличивается. Это подтверждает выполнение второго начала термодинамики.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.