Министерство образования Республики Беларусь
Учреждение образования «Мозырский государственный
педагогический университет имени И.П. Шамякина»
Кафедра теоретической физики
Курсовая работа
Развитие представлений о строении атома студентки 4 курса 2 группы физико-математического факультета Полын Татьяны Иосифовны
Научный руководитель: старший преподаватель
Навныко Валерий Николаевич
Мозырь 2007
Содержание
Введение. 3
1 Модель атома до Бора. 4
1.1 Ядерная модель атома. 4
1.2 Экспериментальная установка. 5
1.3 Две модели строения атома. 6
1.4 Заряд ядра. 10
1.5 Несовместимость планетарной модели атома с представлениями классической физики. 11
2 Модель Бора. 13
2.1 Планетарная модель. 13
2.2. Постулаты Бора. 15
3 Экспериментальное обоснование основных идей квантовой механики. 18
3.1 Линейчатые спектры атомов. 18
3.2 Опыт Франка и Герца. 22
3.3 Опыт Штерна и Герлаха. 23
Заключение. 24
Литература. 25
Приложение 1. 26
Квантовая механика является стержневым разделом «новой» теоретической физики. На протяжении долго времени, почти до конца ХIХ в., считалось, что наименьшими частицами химически простых тел являются атомы. Атомы рассматривались как неделимые частицы материи, «кирпичики мироздания».
Но со временем начали накапливаться экспериментальные сведения, которые указывали на сложную структуру атома. К ним можно отнести открытие электрона, периодического закона Менделеева, линейчатых спектров, явления радиоактивности и др. Было понятно, что атомы представляют сложную электрическую систему, которая имеет размер ~ 0,1 нм. Известно, что классическая механика и электродинамика потерпели фиаско при попытке объяснить атомные явления. Об этом свидетельствует наиболее характерный пример модели атома по Резерфорду, в рамках которой электрон согласно законам электродинамики в результате постоянного излучения энергии при вращении вокруг ядра неизбежно падали на ядро. Такой вывод вступал в противоречие с опытными данными об устойчивости атомов.
В данной курсовой работе подобрана и проанализирована литература, в которой, в доступной форме изложены история возникновения атома, несовместимость планетарной модели атома с представлениями классической физики, а также описаны достоинства и недостатки моделей атома.
Материал курсовой работы позволяет за короткое время ознакомиться с развитием представлений о строении атома. Курсовая работа может быть полезна при подготовке докладов, курсовых и дипломных работ.
В 1897 г. Дж. Дж. Томсоном был открыт электрон; им же в 1903 г. предложена затем физическая модель атома, известная под
названием – «пудинг с изюмом». Согласно
модели Томсона атом представляет положительно
заряженную сферу — пудинг, в котором роль изюминок играли отрицательно заряженные электроны, распределенные так, что вся система в целом была нейтральной. В 1911 г. бывший
ассистент Томсона профессор Эрнест Резерфорд с двумя своими студентами
Гансом Гейгером и Эрнестом Марсденом провели рад опытов по рассеянию ![]() - частиц очень тонкой золотой фольгой. Эти
знаменитые эксперименты показали несостоятельность модели «пудинга с изюмом» и
дали основание Резерфорду высказать предположение, что атом состоит из очень
маленького ядра (диаметром около
- частиц очень тонкой золотой фольгой. Эти
знаменитые эксперименты показали несостоятельность модели «пудинга с изюмом» и
дали основание Резерфорду высказать предположение, что атом состоит из очень
маленького ядра (диаметром около ![]() м) в котором
сосредоточен весь положительный заряд атома, а также большая часть его массы;
это ядро окружено облаком из отрицательно заряженных электронов. Поскольку
размеры атома порядка
м) в котором
сосредоточен весь положительный заряд атома, а также большая часть его массы;
это ядро окружено облаком из отрицательно заряженных электронов. Поскольку
размеры атома порядка ![]() м, то большая часть пространства
в атоме является «пустой»; нейтральность атомов обеспечивается равенством
отрицательного заряда электронов и положительного заряда ядра.
м, то большая часть пространства
в атоме является «пустой»; нейтральность атомов обеспечивается равенством
отрицательного заряда электронов и положительного заряда ядра.
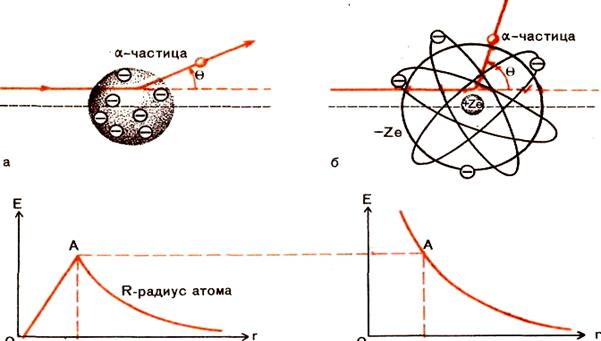 |
Чтобы детальнее изучить строение атома, рассмотрим опыт Резерфорда
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.