



8. Физико-химические свойства аммиака. Зависимость температуры конденсации аммиака от давления. Равновесие реакции синтеза аммиака. Уравнение для расчета константы равновесия. Использование данных по равновесию в системе газ- жидкость для выбора оптимальных условий конденсации аммиака.
8.1.Относительная молекулярная масса………………………………………...17,03
Мольный объем, л/моль………………………………………………………….22,08
Температура кипения при 0,1МПа, 0С………………………………………… – 33,3
Температура плавления, 0С ………..…………………………………………….–77,7
Температура конденсации NH3 увеличивается с увеличением давления.
пределы взрываемости в смеси с воздухом, %об…………………………….15 - 28
с O2, % об…………………………………13,5 - 79
8.2.Зависимость тепмпературы конденсации NH3 от давления
|
Давление |
атм |
0,5 |
1,0 |
5,0 |
10,0 |
30,0 |
|
МПа |
0,051 |
0,101 |
0,507 |
1,013 |
3,040 |
|
|
температура кондесации, 0С |
-46,0 |
-33,3 |
+4,7 |
25,7 |
66,1 |
|
Это позволяет выводить продукционный NH3 из циркуляционного газа, находящегося под давлением в жидком состоянии при повышенных температурах.
По ГОСТ: марка А – для производства НАК, для азотирования, в качестве хладагента, для создания защитных атмосфер; Ак – на экспорт и для транспортирования по магистральному аммиако-проводу; Б – для переработки на удобрения, в с/х. По физико-химическим показателям NH3 должен соответствовать нормам
|
Показатель |
А |
Ак |
Б |
|
1. Массовая доля аммиака, %, не менее |
99,9 |
99,6 |
99,6 |
|
2. Массовая доля азота, %, не менее |
– |
82 |
82 |
|
3. Массовая доля воды (остаток после испарения), % |
– |
0,2 - 0,4 |
0,2 - 0,4 |
|
4. Массовая доля воды (метод Фишера), %, не более |
0,1 |
– |
– |
|
5. Массовая концентрация масла, мг/дм3, не более |
2 |
2 |
8 |
|
6. Массовая концентрация железа, мг/дм3, не более |
1 |
1 |
2 |
|
7. Массовая доля общего хлора, млн-1 (мг/кг), не более |
– |
0,5 |
– |
|
8. Массовая доля оксида углерода (IV), млн-1 (мг/кг), не более |
– |
30 ± 10 |
– |
8.3. Равновесие:
N2(г)+3H2(г)=2NH3(г), ![]() Н= -92кДж -
обратимая экзотермическая. реакция
Н= -92кДж -
обратимая экзотермическая. реакция
Выход NH3 увеличивается при понижении температуры и повышении давления (принцип Ле-Шателье).
К равновесия = РNH3/(PN20.5 PH21.5).
Равновесные концентрации NH3, % об.
Константы равновесия р-ции синтеза NH3, МПа-1
|
t, 0С |
Р, МПа |
||
|
0,98 |
4,9 |
29,4 |
|
|
300 |
14,7 |
39,4 |
71,0 |
|
500 |
1,21 |
5,56 |
26,44 |
|
t, 0С |
Р, МПа |
||
|
0,98 |
4,9 |
29,4 |
|
|
300 |
0,62 |
0,66 |
0,87 |
|
500 |
0,04 |
0,04 |
0,05 |
С увеличением давления равновесные концентрации NH3, % об увеличиваются, а при повышении температуры уменьшаются. К равновесия зависит не только от температуры, но и от давления, это следствие отклонения свойств сжатых газов от свойств идеальных газов.
8.4. Уравнения Кр.
Кр по уравнению Вант-Гоффа :
dlnKp/dT=ΔH/RT2, ΔH – тепловой эффект реакции при температуре Т. Для точного определения теплового эффекта р-ции используется уравнение зависимости
q =f(t, P)
q – тепловой эффект, кДж/кмоль;
Т- средняя температура в колонне синтеза, К;
Р – давление в колонне, МПа.
Зависимость Кр от температуры выражается эмпирическим ур-ем Ларсона и Доджа для обратной р-ции:
lgК1/2 =f(t, Y,β).
β – коэффициент, зависит от давления;
Т- температура, К;
Y – константа интегрирования зависит от давления.
К1*К2=1 – связь между константой прямой и обратной р-ции. Зависимость β и Y в ур-нии Ларсона и Доджа по рис. или из таблицы.
8.5. Равновесие «газ-жидкость»:
Равновесные концентрации NH3 в газе (% об.)
Равновесная концентрация NH3 в газовой фазе, % об
в системе «газ-жидкость» для 5-тикомпонентной системы N2-H2-NH3-CH4-Ar , для 3-х компонентной системы N2- H2- NН3 при Р=29,4 МПа зависит от давления и температуры. Чем ниже температура и выше давление, тем проще выделение NH3 конденсацией.
Накопление инертных примесей Ar, CH4 в синтез-газе плохо, т.к. ведет к увеличению концентрации аммиака в равновесном газе, следовательно, уменьшается степень конденсации аммиака.
|
Содержание СН4+Аr, %об. |
Температура конденсации, 0С |
||
|
-20 |
0 |
+20 |
|
|
0 |
1,32 |
2,90 |
5,64 |
|
10 |
1,46 |
3,16 |
6,16 |
|
20 |
1,59 |
3,43 |
6,65 |
37. Влияние температуры и давления на скорость и степень превращения обратимой экзотермической реакции синтеза аммиака. Линия оптимальных температур (ЛОТ)
Синтез аммиака из N2 и Н2:
N2+3 Н2«2NH3, Н= - 92 кДж относится к числу равновесных обратимых реакций, протекающих с выделением тепла и уменьшением объема. Согласно принципа Ле-шателье, равновесие реакции синтеза аммиака смещается вправо с увеличением давления и уменьшения температуры. Синтез NH3 без применения катализатора даже при высокой температуре протекает медленно. В производственных условиях для получения требуемой скорости реакции синтез NH3 ведут при температурах не ниже 400-5000С и при участии твердых катализаторов.
Скорость обратимой реакции синтеза аммиака описывается уравнением:
U=k*Р3H2РN2
Для увеличения скорости необходимо увеличение константы скорости и давления. Константа скорости р-ции описывается уравнением Аррениуса: k=k0*e-E/RT.
Из анализа уравнения видно, что с увеличением Т (даже незначительно) возрастает константа скорости. Для выбора оптимальных условий процесса необходимо совместно учитывать кинетику и равновесие.
Т.о. для реакции синтеза NH3 установлены следующие зависимости:
![]()
![]()
![]()
![]()
 k K* U
k K* U
![]()

 Графически
Графически
перемножая
![]() эти
графики
эти
графики
![]() получим
получим
![]()
![]()
![]() T Т
Топт
Т
T Т
Топт
Т
Кривая U=f(T) построена из условия, что Х во всем диапазоне изменения температур является const. Если с изменением температуры меняется Х (пример - синтез аммиака), то получаем серию кривых в координатах U и T. ЛОТ – линия, связывающая максимумы отдельных кривых. Оптимальными называются температуры, при которых обеспечиваются максимальные скорости проведения ХТП для достижения заданных степеней превращения.
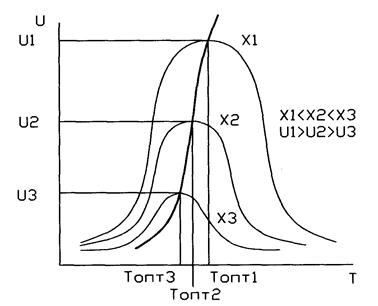
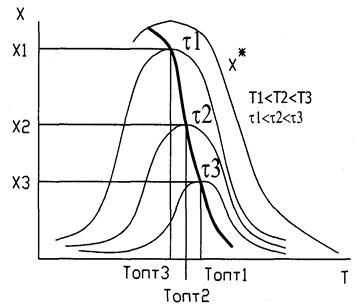
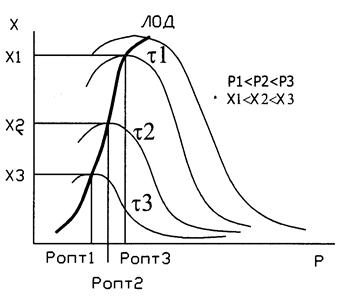 Критерием оптимизации служит максимальная скорость реакции или
максимальная степень превращения.
Критерием оптимизации служит максимальная скорость реакции или
максимальная степень превращения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.