6.Тепловой баланс контактного аппарата.
Условие теплового баланса:
Qприх= Qрасх (6.1)
Q(прих)i= Q1+ Q2 (6.2)
где: Q1 – физическое тепло, поступающее в i–й слой контактного аппарата с газами
при температуре Твх, кДж;
Q2- тепло экзотермической реакции в i-ом слое при окислении SО2 в SО3, кДж
Q(расх)i= Q3 + Q4 (6.3)
где: Q3- потери тепла в окружающую среду, кДж;
Q4- физическое тепло, отходящих газов из i–го слой контактного аппарата при
температуре Твых, кДж;.
6.1.Рассчет теплового баланса 1 слоя контактного аппарата
Расчет проведем на 1 т 100 % Н2SO4 с последующим пересчетом на часовую производительность 75,95 т/ч 100 % Н2SO4
6.1.1. Приход тепловых потоков
1) Q1 – физическое тепло, поступающее в первый слой с газами при температуре
410°С:
Q1 = VГ∙С∙T,
где VГ =1867,518 - объем газа, поступающего на первый слой катализатора ,( м3);
![]() – средняя теплоемкость компонентов,
кДж/(м3∙К);
– средняя теплоемкость компонентов,
кДж/(м3∙К);
Т- температура, К.
Теплоемкость компонентов в зависимости от температуры определим по формулам [26, 27] , кДж/(кмоль∙К):
Для N2 (при 298-2500 К)
![]() =
=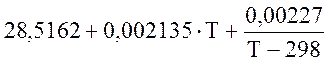
Для О2 (при 298-3000 К)
![]() =
=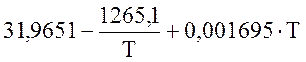
Для SO2 (298-2000 К)
![]() =
=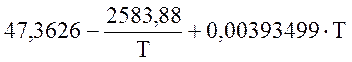
Для SO3 (298-1300 К)
![]() =
=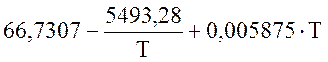
При температуре Т=5000С
Таблица 6.1
Средние теплоемкости компонентов газовой смеси
|
Компоненты |
|
|
|
SO2, |
47,062 |
2,101 |
|
О2 |
31,639 |
1,412 |
|
N2 |
30,167 |
1,347 |
Рассчитаем среднюю теплоёмкость газовой смеси по правилу аддитивности с учётом xi.
![]() (6.2)
(6.2)
где xi-объемная доля компонента в смеси на входе в слой.
![]()
Q1 = 1867,518∙1,443∙683=1840567,848 кДж
2) Определим Q2 – теплоту, выделяющуюся в результате экзотермической реакции окисления SО2 в SО3.
Q2= ΔН ∙V(SO2)i /0,0224
где: ΔН- тепловой эффект реакции, , кДж/моль;
V(SO2)i- объем окислившегося диоксида серы, м3.
Объем окислившегося диоксида серы определим по формуле:
V(SO2)i =V(SO2)∙ ∆Хi
∆Хi- степень превращения для i –го слоя, д.е.
Рассчитаем энтальпии реакций, воспользовавшись справочными данными мольных энтальпий образования веществ [28]
ΔН=∑ni∙ΔH0298 кон - ∑nj∙ΔH0298 исх ,
где ΔH0298 – стандартная мольная энтальпия образования исходных вещества и конечных продуктов, кДж/моль[28].
ni,j – стехиометрические коэффициенты в уравнении реакции для исходных и конечных веществ
Для реакции:
SO2+0,5O2![]() SO3
SO3
ΔН= ΔH0 (SO3) – (ΔH0 (SO2)+ 0,5ΔH0 (O2))
Q2=(98,89∙141,184)/0,0224= 623289,543 кДж
Суммарный приход тепла составит:
Q1п∑ = 1840567,848+623289,543=2463857,391 кДж.
6.1.2. Расход тепловых потоков
1) Потери тепла в окружающую среду принимаем 2 % от общего прихода :
Q3=0,02∙ Q1п∑
Q3=2463857,391∙0,02=49277,148 кДж.
2)Q4-физическое тепло, выносимое отходящими газами [25]:
Обозначим температуру газа, покидающего первый слой контактной массы, через Тх, получим количество тепла, уносимого с газами:
Q4 = VГ∙С∙Tх
С – средняя теплоемкость компонентов, кДж/(м3∙К)
![]()
Q4 =1796,926∙1,489 ∙Tх = 2675,623∙Tх
Составляем уравнение теплового баланса 1 слоя катализатора:
2433245,036 =2675,623∙Tх+ 49277,148
Температура газа, выходящего из первого слоя будет:
Tх=(2463857,391-49277,148)/2675,623=898,44К или 625 0С
Сходимость полученного значения температуры с найденной ранее (6100С) вполне удовлетворительна.
После первого слоя газ направляется в пароперегреватель II ступени. Охладившись там до 450° С, он возвращается во второй слой контактного аппарата.
3) Количество тепла, требуемое отвести в теплообменной аппаратуре, определим по формуле:
Q5= Q4- Q'1
где: Q'1- физическое тепло, поступающее на второй слой с газами при температуре
450°С:
Q5=2414580,243–1934475,429=469411,299 кДж
Суммарный расход тепла составит:
Q1р∑= 2403886,728+49277,148=2463857,036 кДж
Таблица 6.2
Тепловой баланс 1 ступени конверсии (1 слой) на 1т 100% Н2SO4
|
Приход |
Расход |
||||
|
Поток |
МДж |
% |
Поток |
МДж |
% |
|
где Q1 - физическое тепло поступающего на окисление газового потока; |
1840,568 |
74,70 |
Q3 - потери |
49,277 |
2,00 |
|
Q2 – теплота реакции |
623,289 |
25,30 |
Q4 - физическое тепло отходящих газов |
2414,580 |
98,00 |
|
Итого |
2463,857 |
100 |
Итого |
2463,857 |
100 |
6.1.3. Пересчет тепловых потоков на часовую производительность
Проведем перерасчет тепловых потоков на часовую производительность 75,95 т/ч 100 % Н2SO4
1) Q1 – физическое тепло, поступающего в аппарат с газами при температуре 410°С:
Q1=1840567,848∙75,95=139791128,100 кДж
2) Q2 – теплота, выделяющаяся в результате экзотермической реакции окисления SО2 в SО3.
Q2=623289,543∙75,95=47338840,790 кДж
Суммарный приход тепла составит:
Q1п∑ =139791128,100 +47338840,790 =187129968,900 кДж
3) Потери тепла в окружающую среду:
Q3=49277,148 ∙75,95=3742599,391 кДж
4)Q4-физическое тепло, выносимое отходящими газами:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.