Синтез аммиака
1,5Н2 + 0,5N2 ⇄ NН3 + Q
Инерт – азот. Диапазоны варьирования технологических параметров:
температура 200 – 600 °С; давление 10 – 600 атм.
Начальные концентрации активных исходных веществ (% об.):
|
Н2 |
53 |
54 |
55 |
66 |
55 |
|
N2 |
43 |
42 |
41 |
40 |
39 |
Провести моделирование и установить количественную взаимосвязь между основными стехиометрическими и термодинамическими параметрами, определяющими исследуемую химически активную газовую систему:
зависимость коэффициента летучести газовой смеси от технологических параметров
Ке = f (Т, Р) при С0i = const;
зависимость константы химического равновесия от технологических параметров
Кf = f (Т, Р) при С0i = const;
зависимость концентрации целевого продукта в равновесной газовой смеси от технологических параметров Спродукт = f (Т, Р) при С0i = const;
зависимость теплового эффекта химического превращения от технологических параметров Q = f (Т, Р) при С0i = const;
зависимость равновесной степени превращения целевого компонента от основных технологических показателей процесса Хр= f (Т, Р, С0i).
Решение
В данной работе объектом исследования является система химически взаимодействующих реальных газов. Реальная система исследуются с использованием стехиометрической и термодинамической моделей реактора.
Балансный состав реакционной смеси газов моделируется стехиометрическим реактором. При моделировании задаются начальные концентрации исходных веществ и степень превращения целевого компонента. Равновесная степень превращения целевого компонента моделируется термодинамическим реактором.
При заданных соотношениях начальных концентраций реагентов водород - в недостатке. Выбираем целевым компонентом Н2.
Условия проведения химического превращения задаются температурой и давлением процесса. Как объем перерабатываемых веществ, так температура и давление процесса – это традиционные технологические параметры для любого процесса химической технологии.
Проведем анализ системы при с0Н2 = 53%, шаг Т = 100°С, Р = 10, 100, 200, 400, 600 атм.
|
Т |
Ке при Р=10 |
Ке при Р=100 |
Ке при Р=200 |
Ке при Р=300 |
Ке при Р=400 |
Ке при Р=500 |
Ке при Р=600 |
|
200 |
0,973 |
0,755 |
0,562 |
0,425 |
0,344 |
0,311 |
0,299 |
|
400 |
0,988 |
0,885 |
0,787 |
0,703 |
0,643 |
0,576 |
0,527 |
|
600 |
0,993 |
0,932 |
0,872 |
0,817 |
0,769 |
0,725 |
0,686 |
|
Т |
Кр при Р=10 |
Кр при Р=100 |
Кр при Р=200 |
Кр при Р=300 |
Кр при Р=400 |
Кр при Р=500 |
Кр при Р=600 |
|
200 |
0,68374 |
0,88092 |
1,18316 |
1,56607 |
1,93647 |
2,13952 |
2,22368 |
|
400 |
0,02656 |
0,01591 |
0,01791 |
0,02003 |
0,02223 |
0,02447 |
0,02671 |
|
600 |
0,02656 |
0,00266 |
0,00179 |
0,00191 |
0,00203 |
0,00215 |
0,00227 |
При изменении с0 значения коэффициента летучести газовой смеси Ке и константы химического равновесия Кр не изменяются, т.е. зависят только от технологических параметров Т и Р.
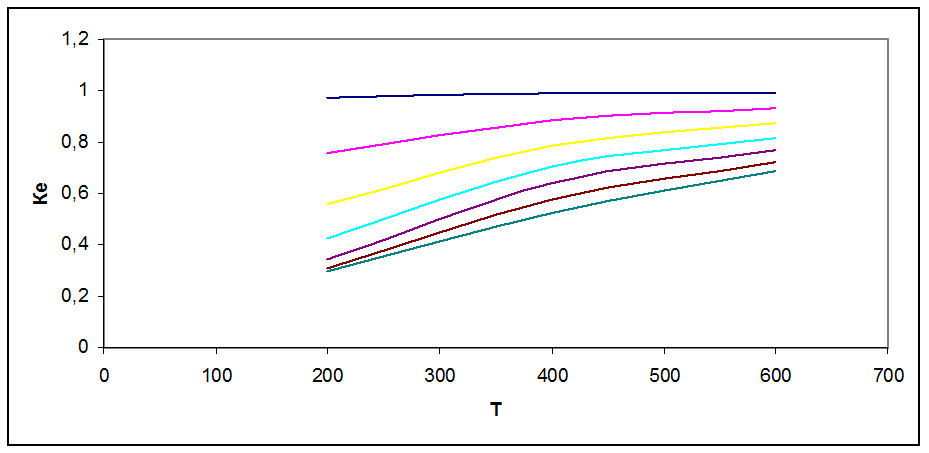
Рис. 1 Зависимость коэффициента летучести от Т и Р
Коэффициент летучести характеризует меру отклонения реального газа от идеального Ке = fi/pi. На графике рис.1 видно, что при Р = 10 атм Ке → 1, т.е. свойства газа приближаются к свойствам идеального. С повышением давления отклонение увеличивается, Ке<<1. Рост температуры увеличивает коэффициент летучести
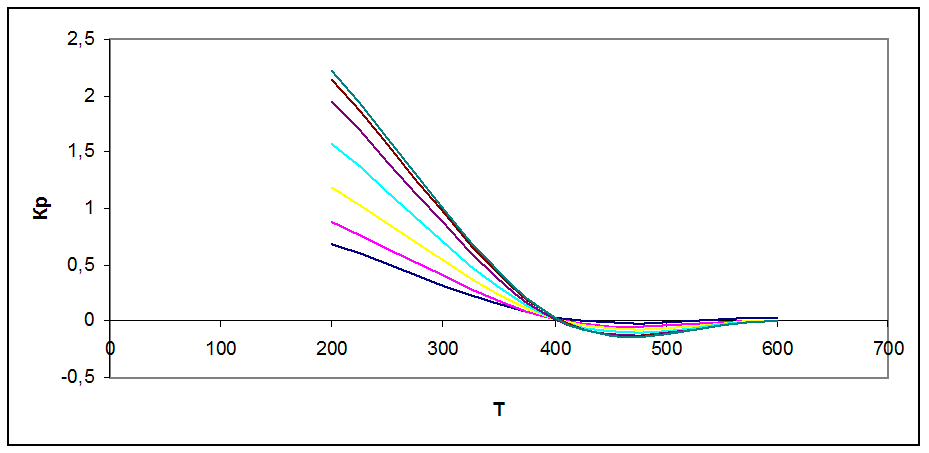
Рис. 2 Зависимость константы химического равновесия от Т и Р
Реакция экзотермическая, по принципу Ле Шателье повышение Т смещает равновесие реакции влево, что подтверждает график рис.2 (константа химического равновесия уменьшается. При повышении давления равновесие сдвигается в направлении образования веществ с меньшим объемом. Так, видно, что при Р = 10 атм кривая более крутая, чем при 100 атм и быстрее стремится к нулю. С повышением Р равновесная кривая смещается вправо, т.е. процесс можно вести при больших Т и с большим выходом продукта
Анализ зависимости концентрации целевого продукта в равновесной газовой смеси от
технологических параметров Спродукт = f (Т, Р) при С0i = const:
|
Т |
С при Р=10 |
С при Р=100 |
С при Р=200 |
С при Р=300 |
С при Р=400 |
С при Р=500 |
С при Р=600 |
|
|
200 |
41,94 |
59,66 |
62,17 |
63,20 |
63,71 |
63,96 |
64,11 |
|
|
Со=53% |
400 |
6,72 |
23,71 |
34,16 |
40,47 |
44,76 |
47,86 |
50,21 |
|
600 |
6,72 |
6,72 |
8,61 |
12,38 |
15,81 |
18,94 |
21,79 |
|
Т |
С при Р=10 |
С при Р=100 |
С при Р=200 |
С при Р=300 |
С при Р=400 |
С при Р=500 |
С при Р=600 |
|
|
200 |
42,82 |
61,16 |
63,77 |
64,84 |
65,37 |
65,64 |
65,79 |
|
|
Со=54% |
400 |
6,72 |
24,11 |
34,82 |
41,30 |
45,72 |
48,93 |
51,35 |
|
600 |
6,72 |
6,72 |
8,73 |
12,56 |
16,06 |
19,25 |
22,15 |
|
Т |
С при Р=10 |
С при Р=100 |
С при Р=200 |
С при Р=300 |
С при Р=400 |
С при Р=500 |
С при Р=600 |
|
|
200 |
43,69 |
62,68 |
65,40 |
66,51 |
67,07 |
67,34 |
67,50 |
|
|
Со=55% |
400 |
6,72 |
24,51 |
35,47 |
42,13 |
46,69 |
50,00 |
52,50 |
|
600 |
6,72 |
6,72 |
8,85 |
12,74 |
16,30 |
19,55 |
22,51 |
|
Т |
С при Р=10 |
С при Р=100 |
С при Р=200 |
С при Р=300 |
С при Р=400 |
С при Р=500 |
С при Р=600 |
|
|
200 |
44,56 |
64,22 |
67,05 |
68,22 |
68,80 |
69,08 |
69,25 |
|
|
Со=56% |
400 |
6,72 |
24,90 |
36,11 |
42,96 |
47,65 |
51,07 |
53,66 |
|
600 |
6,72 |
6,72 |
8,96 |
12,92 |
16,54 |
19,84 |
22,86 |
|
Т |
С при Р=10 |
С при Р=100 |
С при Р=200 |
С при Р=300 |
С при Р=400 |
С при Р=500 |
С при Р=600 |
|
|
200 |
45,42 |
65,78 |
68,73 |
69,95 |
70,56 |
70,86 |
71,03 |
|
|
Со=57% |
400 |
6,72 |
25,28 |
36,74 |
43,77 |
48,60 |
52,13 |
54,81 |
|
600 |
6,72 |
6,72 |
9,08 |
13,09 |
16,76 |
20,13 |
23,20 |
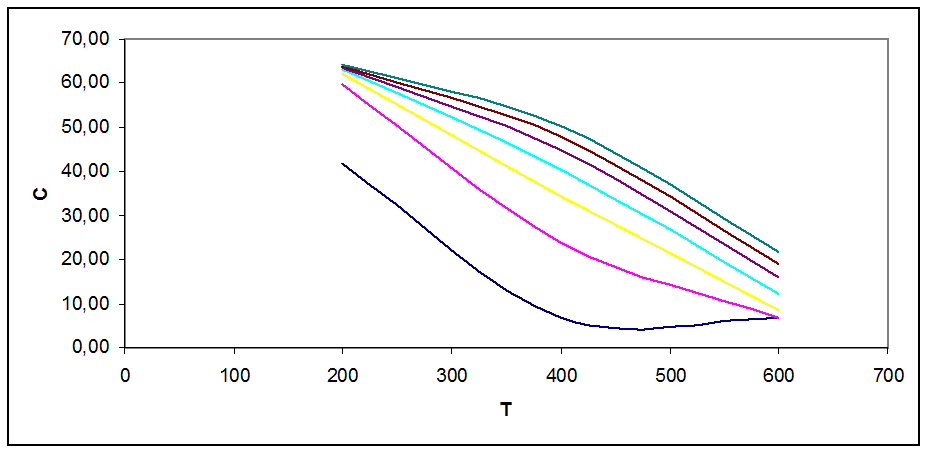
Рис. 3.1. Зависимость концентрации продукта в смеси от Т, Р при С0=53 % об
.
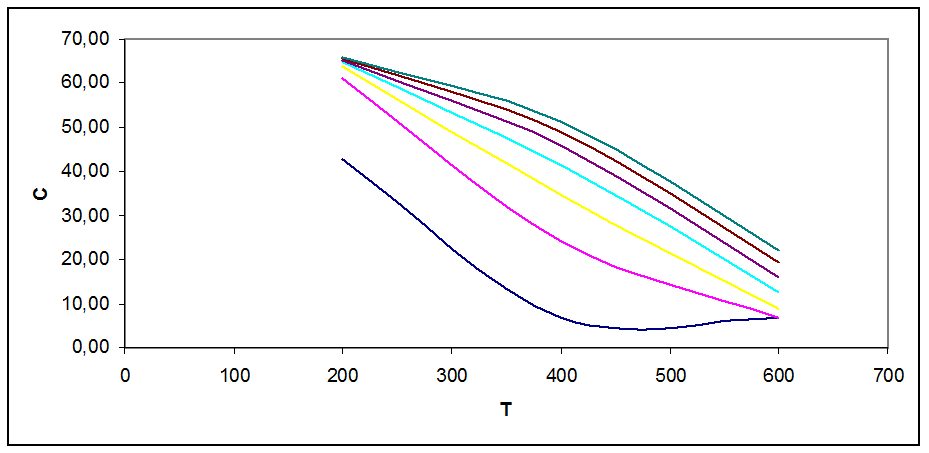
Рис. 3.2. Зависимость концентрации продукта в смеси от Т, Р при С0=54 % об.
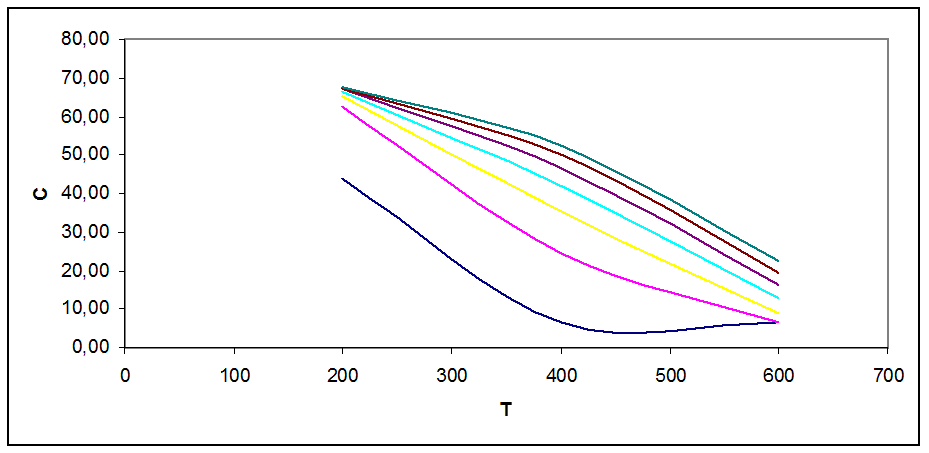
Рис. 3.3. Зависимость концентрации продукта в смеси от Т, Р при С0=55 % об
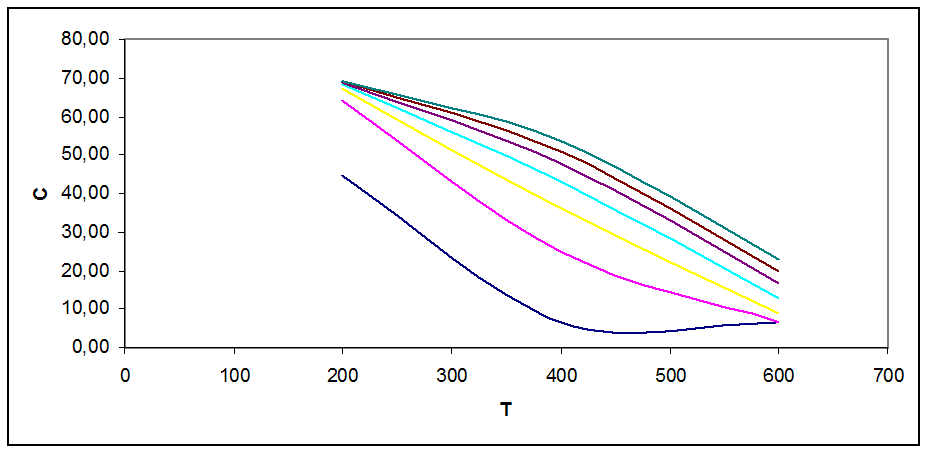
Рис. 3.4. Зависимость концентрации продукта в смеси от Т, Р при С0=56 % об
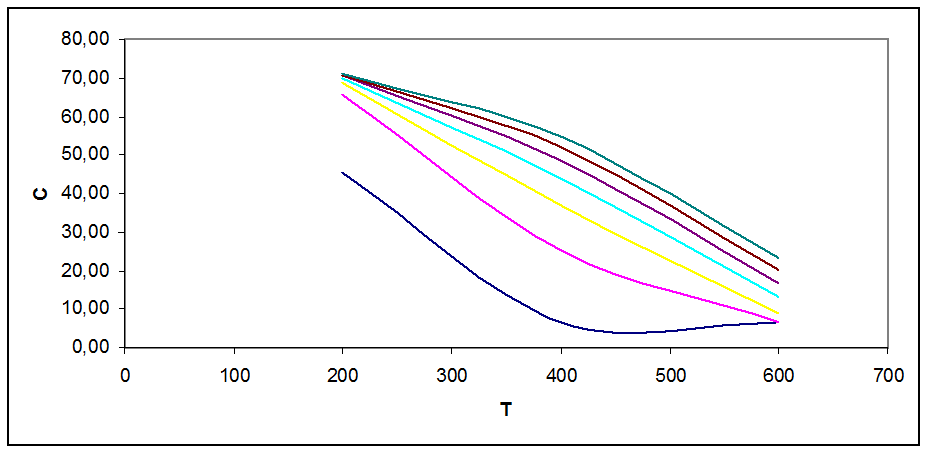
Рис. 3.5. Зависимость концентрации продукта в смеси от Т, Р при С0=57 % об
На графиках рис. 3.1 - 3.5 видно, что с ростом Т концентрация продукта снижается (то же показал анализ Кр). Кривые при разных давлениях показывают, что повышение давления повышает концентрацию продукта в смеси.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.