8) Находим общее кол-во реакционного тепла, выделяющегося по р-ям (1) и (2) при неселективной очистке: х = х1+ х2= 16911,83 МДж. Рассмотрим р-ю (3):
9) Найдем какое кол-во NO прореагировало. Оно равно 60 нм3/ч.
10) Найдем кол-во тепла, выделяющееся по р-ции (3) при селективной очистке: 6*0,0224 м3----1811кДж, 60 м3-----х3 кДжÞ х3=808,48 МДж.
Билет №23
Задача. В распор-ии технолога им-ся 3 исх-х в-ва для пригот-ия р-ров КАС:70%-й р-р CO(NH2)2, 85%-й р-р NH4NO3 и Н2О. Рассчит-те расход сырья на пригот-ие указ-х марок удобр-ия. Опр-те для каждой марки: состав, общее содерж-ие N, tº кристалл-и. Расчеты вести на 1000 кг смеси 70% CO(NH2)2 и 85%-го р-ра NH4NO3.
Марки: 1)уд-ие, имеющее tº кристалл-и +10 ºС; 2)уд-я с масс-й долей общ. N 27% и min возможной tº крист-ии; 3)уд-ия с масс. Долей 30% CO(NH2)2 и 30% NH4NO3.
Решение
1)Проводим линию, она пересек-т линию изотермы +10ºС в 2-х точках Е и F. Т.о.,имеется 2 состава КАС, удовлетвор-х зад-му усл-ю. Координаты состава Е: CO(NH2)2 – 40%, NH4NO3 – 37%, Н20 – 23%. Состав F: CO(NH2)2 – 28% ,NH4NO3 – 52%, Н20 – 20%.
Расчет масс для пригот-ния составов: Состав F: g(исх) р-ра CO(NH2)2 – Х кг g(исх) р-ра NH4NO3 – 1000-Х кг
Х/ (1000-Х)= FD/FС=35/54, Х=393 кг р-ра CO(NH2)2 1000-393=607 кг р-ра NH4NO3 Общего азота – 31,8%
2) Условию удобр-я данного состава отв-т Н: 27%N, tº крист. тin, т.е. Н лежит на линии перегиба изотермы; составы, наход-ся справа и слева, им. более выс. tº крист.
Состав в т. Н: CO(NH2)2 – 30% ,NH4NO3 – 38%, Н20 – 32%, сод-ие общегоN – 27%. tº крист.= -20 ºС.
Готовим состав G: g CO(NH2)2 – Х кг g NH4NO3 – 1000-Х кг
Х/ (1000-Х)= GD/ GС=43/47, Х=478 кг р-ра CO(NH2)2 1000-478=522 кг р-ра NH4NO3
К составу, отвечающему т. G, + Н2О. У – масса добавляемой воды. У/1000= GН/ КН=10/64 У=156 кг
3) g CO(NH2)2 – Х кг g NH4NO3 – 1000-Х кг
Х/ (1000-Х)= МD/СМ=49/41, Х=544 кг р-ра CO(NH2)2 1000-544=456 кг р-ра NH4NO3
У – масса добавляемой воды
У/1000= LМ/ LК=16/56 У=286 кг
1000+286=1286 – масса смеси.
Билет №24
Задача.
При аварийной остановке агрегатов по пр-ву НАК происходит выброс через свечу в атмосферу всех нитрозных газов, находящихся в абсорбционной колонне и др. аппаратах. Давление при этом падает до атмосферного. Рассчитаем объём нитрозных газов и массу оксида азота (NO2), если среднее содержание NO2 в нитрозном газе при выбросе равно 3,5 % об., а температура =40ºС. Расчёт выполнить для 3-х типов агрегатов, необходимые данные для расчёта приведены в следующей таблице.
|
Показатель |
Тип I |
Тип II |
Тип III |
|
Производительность , т/год (в пересчете на 100 % НNO3) |
50000 |
120000 |
360000 |
|
Концентрация НNO3, % масс. |
48 |
58 |
60 |
|
Давление в системе, МПа |
0,35 |
0,7 |
1,0 |
|
Объём окислителя , м³ |
45 |
63 |
- |
|
Объём др. аппаратуры, м³ |
40 |
60 |
150 |
|
Диаметр абсорбционной колонны, м |
3,0 |
3,2 |
4,0 |
|
Высота абсорбционной колонны, м |
44,7 |
46,4 |
57,6 |
Тип I.1)Объём
абсорбционной колонны: ![]()
2) Общий объём аппарата:315,8+45+40=400,8 м³
3).Объём НГ, поступающих при выбросе в атмосферу в пересчёте на н.у.: Vвыбр=Vо- Vо΄,
где Vо- объём газа в аппаратах при рабочем давлении в пересчёте на норм.условия, м³; Vо΄ - объём газа при рабочем давлении (0,1013 МПа) в пересчёте на норм. температуру, м³.
Т.о., расчёт по (2) означает, что в атмосферу выбрасывается избыток НГ, создающий давление в системе сверхатмосферного. Выброс длится до тех пор, пока давление в системе не уравняется с атм. Объём оставшегося в аппаратах НГ= Vо΄. Для расчёта Vо используем Ур-е Клапейрона или объединённого газового закона:
![]() ,тогда
,тогда
![]()
При аварийном выбросе р в системе падает до атм. Обычно разница м/д ратм. и ро невелика, т.е. ратм.= ро=0,1013 МПа= const, тогда для расчёта Vо можно воспользоваться з-ном Гей-Люссака:
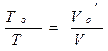 :
: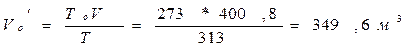 ;Vвыбр.=1207,8-349,6=858,2 м2
;Vвыбр.=1207,8-349,6=858,2 м2
4)Расчёт массы NО2
выполняется по ф-ле:![]() ,
,
где Vвыбр –объём выбр. НГ,м³ ;СNO2 – объёмная доля NO2 в НГ, доли ед.;М NO2 – масса 1 кмоля NO2;22,4 - объём 1 кмоля NO2 , м³/кмоль.
![]()
Тип II.1.Vk =373,0
м³; 2.V=373+63+60=496 м³; 3. ![]() ;Vo´=432,6 м³;Vвыбр=28989,4-432,6=2556,8
м³
;Vo´=432,6 м³;Vвыбр=28989,4-432,6=2556,8
м³
4. ![]()
Тип III 1.Vk =723,5
м³;2.V=723,5+150=873,5 м³;3. ![]() ;Vo´=761,9 м³;Vвыбр=6759,0
м³ 4.
;Vo´=761,9 м³;Vвыбр=6759,0
м³ 4. ![]()
Выводы:
1.Результаты расчёта свидетельствуют о существенном увеличении абсолютного аварийного выброса токсичного NO2 с повышением единичной мощности агрегата. Вместе с тем даже незначительное повышение выброса по сравнению с базовым уровнем (тип 1) следует рассматривать как ухудшение экологической обстановки.
2.Сопоставим динамику изменения выброса NO2 с увеличением единичной мощности агрегата. Мощность увеличивается в последовательности 50000:120000:360000=1:2,4:7,2. Массовый выброс NO2 увеличивается в последовательности 61,7:183,8:485,8=1:3:7,9. Т.о., повышение аварийного выброса NO2 происходит в большей мере нежели возрастание мощности агрегата.
Билет №25
Задача. 1) для суммарной реак-и обжига серн колч-на при t=750°С или Т=1023К: 4FeS2+11O2=2Fe2O3 + 8SO2
DН0298=[ 2*(-822,16)+8*(-296,9)]-[4*(-177,4)]= -3309,92кДж,
DS0298=(87,45*2+248,07*8)-(205,04*11 +52,93*4)= -307,7 Дж/К,
![]() =
-3309,92 - 1023*(- 0,3077)= - 2994,8 кДж.
=
-3309,92 - 1023*(- 0,3077)= - 2994,8 кДж.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.