Задание на РГЗ по ХТНВ заочн 33ХТ-51
Расчетно-графическое задание состоит из четырех задач. Для задач 1,2,3 имеется два варианта, для задачи 4 – вариант для каждого студента.
|
ФИО студента |
Вариант для задач 1,2,3 |
Вариант для задачи 4 |
|
Буланова Светлана Александровна |
1 |
1 |
|
Качанов Дмитрий Евгеньевич |
2 |
2 |
|
Косулина Наталья Александровна |
1 |
3 |
|
Лошкова Мария Владимировна |
2 |
4 |
|
Опарина Ирина Владимировна |
1 |
5 |
|
Разумова Эльвира Николаевна |
2 |
6 |
|
Смирнова Юлия Владимировна |
1 |
7 |
Оформление: на компьютере. Содержание отчета: титульный лист (на титульном листе обязательно должна быть подпись студента, дата сдачи на проверку и вариант задания), решение задач, ответы, таблицы, графики, список использованной литературы. Поля: верхнее, нижнее 15; левое 25; правое 10. Лист с рамкой и основной надписью. Оглавление не требуется. Шрифт 12 пт, интервал полуторный, текст с абзацем 12 мм выравнивание по ширине, таблицы, рисунки, формулы нумеруются, нумерация сквозная. Величины, входящие в формулы расшифровываются непосредственно после формулы.
РГЗ должно быть сдано на проверку перед зимней сессией.
Задача 1
Рассчитать значение константы равновесия для интервала температур t, построить график зависимости K = f(T) и сделать вывод. Указать все способы смещения равновесия указанной реакции вправо, т.е. в сторону образования продуктов реакции.
Вариант 1. Реакция конверсии метана:
CH4 + H2O « CO + 3H2, DH>0
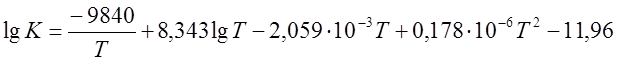 ,
,
где Т – температура, К.
t = 600; 700; 800; 900; 1000 оС.
Вариант 2. Реакция конверсии СО:
CO + H2O « CO2 + H2, DH<0
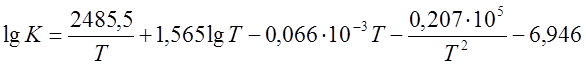 ,
,
где Т – температура, К.
t = 250; 350; 450; 550; 650 оС.
Рассчитать среднюю теплоемкость парогазовой смеси (ПГС), подаваемой на паровую конверсию метана, при температурах t. Состав ПГС, м3: CH4 – 93,8; C2H6 – 3,3; C3H8 – 1,6; N2 – 3,854; H2 – 7,416; Ar – 0,03; H2O – 370.
Вариант 1: 525, 535, 545 оС. Вариант 2: 500, 520, 560 °С.
Расчет теплоемкости выполнить по правилу аддитивности:
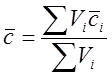 ,
,
где Vi – объем компонента в смеси газов, м3; сi – средняя объемная теплоемкость компонента в смеси газов, кДж/(м3×К).
Теплоемкости компонентов смеси рассчитать по следующим формулам в кДж/(кмоль×К) и перевести в кДж/(м3×К):
Для H2 (при 298-3000 К):
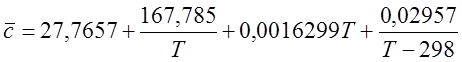
Для N2 (при 298-2500 К):
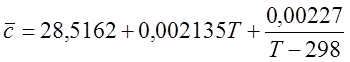
Для H2O (при 298 – 2500 К):
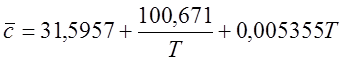
Для CH4 (при 298-1500 К):
![]()
Для C2H6 (при 298-1500 К):
![]()
Для C3H8 (при 298-1500 К):
![]()
Для Ar:
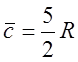 ,
,
где R – универсальная газовая постоянная.
Привести подробное решение для одной температуры, для остальных температур – только результаты. Ответ представить в кДж/(м3×К).
Рассчитать степень окисления NO в NO2 для следующих исходных данных.
|
Параметр |
Вариант 1 |
Вариант 2 |
|
1. Расход нитрозных газов (НГ), нм3/ч |
20000 |
60000 |
|
2. Окислительный объем, м3 |
20 |
50 |
|
3. Давление, ат |
5 |
7 |
|
4. Температура, оС |
70 |
110 |
|
5. Начальная концентрация NO в НГ, % об. |
3 |
4 |
|
6. Начальная концентрация O2 в НГ, % об. |
5 |
5 |
Рассчитать состав НГ на выходе из окислителя. Для расчетов использовать уравнение:
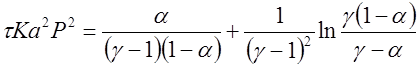 ,
,
где a - степень окисления NO, доли ед.; t - время окисления, с; K – константы
скорости реакции, 1/[(% об.)2×с]; а
– половина начальной концентрации NO, % об.; Р – общее давление газа, ат; 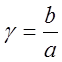 - отношение концентрации кислорода к
половинной концентрации NO.
- отношение концентрации кислорода к
половинной концентрации NO.
Зависимость константы скорости реакции окисления NO от температуры
|
Температура, оС |
0 |
30 |
60 |
100 |
|
К, |
34800 |
26500 |
21800 |
18000 |
|
К, |
0,00693 |
0,00428 |
0,00292 |
0,00195 |
Расчет по данному уравнению выполняется в следующей последовательности:
Определяются t, К, а, Р, g. Вычисляется левая часть уравнения ![]() .
По номограмме Каржавина (см. справочный материал рис. 164) по значениям
.
По номограмме Каржавина (см. справочный материал рис. 164) по значениям ![]() и g
определяется интервал a. Например, a изменяется от 0,6 до 0,7.
и g
определяется интервал a. Например, a изменяется от 0,6 до 0,7.
Затем уточняют
a подстановкой значений границ
интервала (для указанного в примере интервала границами являются 0,6 и 0,7) и
значения середины интервала (0,65) в правую часть уравнения и находят значение
правой части. Таким образом, получаеются три точки, по которым строится график:
на оси абсцисс откладывается a, на оси
ординат правая часть уравнения при соответствующих значениях a. По графику находится точное значение a по значению левой части уравнения ![]() , вычесленной ранее.
, вычесленной ранее.
Далее вычисляется состав НГ на выходе.
Задача 4
Вариант 1
Составить материальный и тепловой баланс среднетемпературного конвертора СО производительностью по аммиаку 1320 т/сут. Расчет вести на 100 м3 сухого газа на входе.
Исходные данные:
Состав сухого газа на входе, % об.: Н2 – 57,12, N2 – 22,22, СО – 11,75, СО2 – 8,33, CH4 – 0,30, Ar – 0,28.
Объемное отношение на входе в реактор пар:сухой газ определить расчетом материального баланса.
Температура ПГС на входе в реактор 385 оС.
Соотношение между компонентами газа на выходе при условии достижения равновесия задается величиной константы равновесия реакции при 400 оС.
Степень превращения СО составляет 0,85.
Давление газа на выходе 27,2 атм.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.