Уравнение (2.31) является общим и справедливо для любых давлений, температур и составов фаз.
Давление насыщенных паров Рнас определяли по уравнению Антуана [59]:
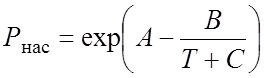 (2.32)
(2.32)
где А,В,С – коэффициенты для данного компонента; Т – температура, К; Рнас – в мм рт. ст.
Поправка Пойнтинга была рассчитана по уравнению:
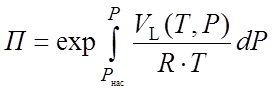
где VL(Т,Р) – функциональная зависимость мольного объема жидкости VL от температуры T и давления Р.
Подробнее математический аппарат можно смотреть в [59].
В программе MathCAD 2000 были рассчитаны поправки Пойнтинга для метанола и воды. Результаты расчета показали, что в диапазоне давлений 1 – 100 атм и температур 0 – 250 °С поправка Пойнтинга для метанола и воды равна единице с точностью до шестого знака после запятой.
Математический аппарат для вычисления коэффициентов фугитивности Ф громоздок и сложен, и поэтому здесь не приводится. Подробнее его можно смотреть в [59].
Для заданного состава газовой фазы в программе MathCAD 2000 были рассчитаны коэффициенты фугитивности метанола и воды. Результаты показали, что Ф для метанола и воды при 40-80 °С и 60-80 атм отличаются от единицы на 2-5 %. Однако включение блока расчета коэффициентов фугитивности в общую математическую модель требует очень сложных итерационных процедур, т.к. Ф зависит от равновесного состава газа, а последний сам зависит от Ф. Поэтому мы приняли, что без больших погрешностей можно считать Ф равными единице как для метанола, так и для воды.
Коэффициент фугитивности жидкости Фs в [59] рекомендуют считать его равным 1 при температурах жидкостей, значительно ниже критической. В нашем случае температура процесса 40 – 50 °С, критическая температура метанола – 239,6 °С, воды – 374,3 °С. Мы посчитали возможным принять рекомендации и не рассчитывать Фs.
Коэффициенты активности компонентов в жидкой фазе можно рассчитать уравнению Ван-Лаара [59] для бинарной жидкой смеси:
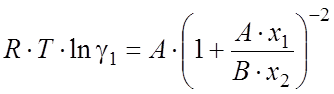 (2.33)
(2.33)
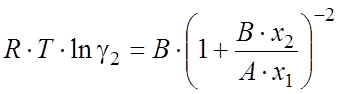 (2.34)
(2.34)
где xi – мольные доли компонентов; A и B - так называемые настраиваемые параметры, определяемые следующим образом. При бесконечном разбавлении x1 ® 0 или x2 ® 0, тогда уравнения (2.33,2.34) принимают вид:
![]() (2.35)
(2.35)
![]() (2.36)
(2.36)
где g¥ - коэффициент активности при бесконечном разбавлении, рассчитываемый по уравнению [59]:
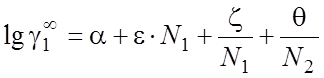 (2.37)
(2.37)
где a, e, z, q - коэффициенты для первичных спиртов, если растворитель – вода, или для воды, если растворитель – первичный спирт; N1, N2 – общее число углеродных атомов в молекулах 1 и 2 соответственно.
Коэффициенты a, e, z, q зависят от температуры, соответствующие табличные данные из [59] аппроксимированы полиномами 2-й степени: a = f(t), e = f(t), z = f(t), q = f(t).
С помощью пакета MathCAD 2000 рассчитали коэффициенты активности метанола и воды в их бинарном растворе. Результаты расчета приведены в таблице 1.
Таблица 1.
Результаты расчета коэффициентов активности
|
Температура, °С |
Коэффициент активности метанола |
Коэффициент активности воды |
||||||||||
|
Мольная доля метанола в растворе |
Мольная доля воды в растворе |
|||||||||||
|
0,001 |
0,2 |
0,4 |
0,6 |
0,8 |
0,999 |
0,001 |
0,2 |
0,4 |
0,6 |
0,8 |
0,999 |
|
|
20 |
4,036 |
2,172 |
1,464 |
1,161 |
1,034 |
1,000 |
2,767 |
2,074 |
1,587 |
1,262 |
1,069 |
1,000 |
|
40 |
4,134 |
2,203 |
1,475 |
1,165 |
1,034 |
1,000 |
2,822 |
2,102 |
1,600 |
1,267 |
1,070 |
1,000 |
|
60 |
4,367 |
2,253 |
1,487 |
1,167 |
1,035 |
1,000 |
2,878 |
2,142 |
1,624 |
1,279 |
1,073 |
1,000 |
|
80 |
4,757 |
2,322 |
1,498 |
1,168 |
1,034 |
1,000 |
2,935 |
2,192 |
1,659 |
1,298 |
1,079 |
1,000 |
Как видно, коэффициенты активности могут очень сильно отличаться от единицы, поэтому их учет необходим для корректного расчета.
Итак, приняв П = 1, Ф = 1, Фs = 1 и рассчитав g, записывали уравнение (2.31) для метанола и воды. Полученную систему уравнений необходимо решать методом итераций.
В случае конденсации только одного компонента его объем в выходящей газовой смеси Vвых,в (нм3/ч) определяли по формуле [19]:
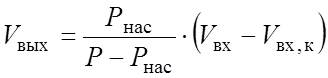 (2.38)
(2.38)
где Рнас - давление насыщенных паров конденсирующегося компонента при заданной температуре, ата; Vвх - общий объем входящего газа, нм3/ч; Vвх,к - объем конденсирующегося компонента на входе, нм3/ч.
Массовый расход жидкой фазы Gж (кг/ч) находили по формуле:
Gж = (Vвх,в - Vвых,в)×М/22,4 (2.39)
Таким образом, в разделах 2.4.1. и 2.4.2. приведен математический аппарат, формализующий химические превращения веществ и изменение их агрегатных состояний. Перейдем теперь к вопросу формализации процессов обмена тепловой энергией.
2.4.3. Процессы теплообмена.
2.4.3.1. Основные положения и принятые допущения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.