При высоких давлениях константу равновесия более правильно выражать через летучести компонентов газовой смеси [1]:
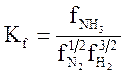 (3.4)
(3.4)
где ![]() — летучести аммиака,
азота и водорода в равновесной газовой смеси; Кf — константа равновесия реакции.
— летучести аммиака,
азота и водорода в равновесной газовой смеси; Кf — константа равновесия реакции.
В этом случае сохраняется независимость константы равновесия от давления. Однако уравнение (3.4) довольно редко используют для расчетов равновесия, так как точное определение парциальных летучестей компонентов газовой смеси является очень сложной задачей. Вместо этого применяют упрощенный метод расчета по правилу Льюиса — Рендалла (3.5), выведенному для идеального газового раствора (азотоводородоаммиачная смесь ведет себя как идеальный раствор реальных газов при давлениях до 60 МПа и температурах выше 350 °С) [1]:
![]() ,
,
![]() ,
,
![]() , (3.5)
, (3.5)
где ![]() — летучести аммиака, азота и
водорода в равновесной газовой смеси;
— летучести аммиака, азота и
водорода в равновесной газовой смеси; ![]() — летучести чистых аммиака,
азота и водорода при общем давлении реакционной смеси;
— летучести чистых аммиака,
азота и водорода при общем давлении реакционной смеси; ![]() — мольные доли аммиака, азота и
водорода в смеси.
— мольные доли аммиака, азота и
водорода в смеси.
Определение летучести чистых аммиака, азота и водорода не представляет большой сложности. Подставляя выражения (3.5) в (3.4), находим
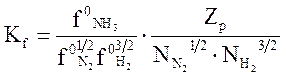 (3.6)
(3.6)
Обозначив 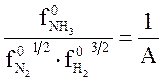 , получим уравнение, аналогичное (3.3)
, получим уравнение, аналогичное (3.3)
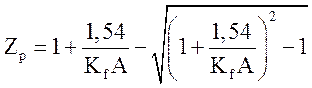 (3.7)
(3.7)
пригодное для расчетов равновесного содержания аммиака в стехиометрической смеси азота и водорода при высоких давлениях. Для низких и умеренных давлений оно превращается в (3.3), так как при этом значения парциальных давлений и летучестей совпадают.
ЧГУ.З.РК.240301.000.004.ПЗ
Лист
10
Из
Лист
№ докум.
Подп.
Дата
.
При отклонении азотоводородной смеси от стехиометрического состава происходит снижение равновесной концентрации аммиака. При разбавлении азотоводородной смеси инертными газами (метаном и аргоном) равновесная концентрация аммиака также уменьшается. Ее можно рассчитать приближенно по формуле (или номограмме) С. Тоноиоло или более точно по уравнению Гиллеспая – Битти [1]. Если же известны равновесные концентрации аммиака в смеси, не содержащей инертных газов, то их можно вычислить и в присутствии инертов по уравнению [1]
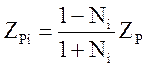 ,
,
где ZР и ZPi— равновесные мольные доли аммиака соответственно без инертных газов и в их присутствии; Ni — концентрация инертных примесей, мольн. доли.
В общем
случае для 1 моля исходной смеси, содержащей ![]() ,
, ![]() ,
, ![]() ,
, ![]() и
и ![]() молей
соответственно N2, Н2, NН3, СН4,
Аr
равновесие можно рассчитать по уравнению, выведенному из (3.1) [1]:
молей
соответственно N2, Н2, NН3, СН4,
Аr
равновесие можно рассчитать по уравнению, выведенному из (3.1) [1]:
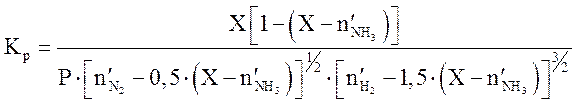 , (3.9)
, (3.9)
где Х — равновесное содержание аммиака в
смеси, моль; ![]() —
число молей аммиака, образующегося в результате реакции;
—
число молей аммиака, образующегося в результате реакции; ![]() — суммарное число молей в
равновесной смеси.
— суммарное число молей в
равновесной смеси.
Решая квадратное уравнение (3.9), находим X. Содержание компонентов (мольн. доли) в равновесной смеси определяются по уравнениям
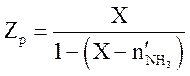 ,
,
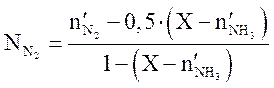 ,
,
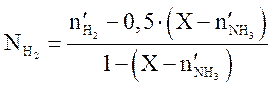 ,
,
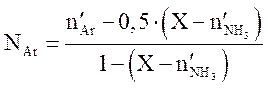 ,
,
ЧГУ.З.РК.240301.000.004.ПЗ
Лист
11
Из
Лист
№ докум.
Подп.
Дата
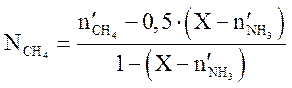 . (3.10)
. (3.10)
Тепловой эффект реакции
Тепловой эффект реакции синтеза аммиака в реальных условиях проведения процесса состоит из двух слагаемых [1]:
Q = Qp + Qсм (3.11)
где Qр—тепловой эффект реакции при полном превращении азотоводородной смеси в аммиак; Сcм — теплоты смешения аммиака с азотоводородной смесью. Qp и Qсм, а следовательно и Q, зависят от температуры и давления. Значения Qp можно рассчитать по уравнению [1]
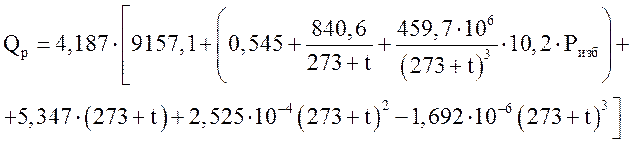 (3.12)
(3.12)
где Р — избыточное давление, МПа; ![]() — температура, °С.
— температура, °С.
Теплоты смешения (Qсм) при разных давлениях, температурах и концентрации аммиака в смеси (17,6; 20; 40; 80% МН3) были определены Я. С. Казарновским и др. Qсм, в отличие от QР, является отрицательной величиной, так как при смешении сжатых азота, водорода и аммиака происходит поглощение тепла. При низких давлениях теплоты смешения пренебрежимо малы, при высоких — они достигают значительных величин и не учитывать их было бы неправильным.
Кинетика синтеза аммиака.
Синтез аммиака из азота и водорода протекает с заметной скоростью только в присутствии катализатора. Скорость синтеза аммиака на большинстве известных катализаторов описывается уравнением Темкина — Пыжева [1-3]
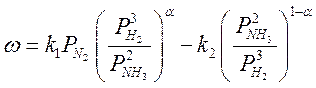 (3.13)
(3.13)
ЧГУ.З.РК.240301.000.004.ПЗ
Лист
12
Из
Лист
№ докум.
Подп.
Дата
где w — наблюдаемая скорость реакции, равная разности скоростей образования и разложения аммиака; k1 k2 — константы скорости образования и разложения аммиака (отношение k1/k2=KР, где KР — константа равновесия); Рн2, PN2, рNнз — парциальные давления водорода, азота и аммиака; a — постоянная, удовлетворяющая неравенству 0<a<1.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.