1.Биологический и технический способы связывания атм. азота, их достоинства и недостатки. Способы получения водорода - сырья для синтетического аммиака. Расчет теплового баланса процесса конверсии СО (I или II ступени) при получении синтез-газа из природного газа.
N2 – имеет три двойные связи, это один из 4-х важнейших элементов (H, C, N, O). N входит в состав важных соединений: белков, нуклеиновых кислот, ферментов, нуклеопротеидов. N составляет ~3% массы живой клетки и ~ 10% сухой массы организма человека. Белки синтезируются растениями из нитратов или аммонийных солей, непосредственно N воздуха им не доступен.
1.1.Существует биологический способ связывания азота: бактерии, живущие в симбиозе с корнями бобовых растений питаются соками растений, поглощают N из воздуха и перерабатывают его в форму доступную растениям. В начале 20 века были обнаружены свободно живущие азотобактерии, которые также способны превращать N воздуха в усвояемую растениями форму. Достоинства : экологически чистый, простой способ. Недостатки: малая V процесса.
Технологический способ синтеза из атмосферного N
1) дуговой метод. При высокой t (≈ 3000оС) N2 соединяется с О2 воздуха.
N2+O2 = 2NO , +179,
2NO+O2=2NO2, –114
NO2 поглощается Н2О с образованием НNO3. Выход NO составляет 3-5%. Этот метод нерентабелен, т. к. малый выход NO и большие затраты электроэнергии на образование электрической дуги.
2) Цианамидный метод. Карбид кальция при t ≈ 1000 0C взаимодействует с N2.
N2+СаС2 = СаСN2+С,+301.
Этот метод экономичнее, но его роль незначительна.
3) Аммиачный метод. Основан на реакции
N2+3Н2=2NН3,-92
Он менее энергоемок, более производителен, широко распространен и стимулирует производство НNО3 и азотных удобрений:
NН3+2О2=НNО3+Н2О;
NН3+НNО3=NН4NО3
2NН3+СО2=СО(NН2)2+Н2О
1.2.. по 1-му способу: N2 получают из воздуха его разделением, которое основано на различных температурах кипения его компонентов. Сначала воздух сжижают путем сжатия и охлаждают, затем разделяют последующим испарением компонентов в ректификационных колоннах. По 2-му (широко используется): воздух добавляют к Н2-содержащему газу и затем химическими методами удаляют все остальные компоненты кроме N2 и Н2, получается чистая 2-х компонентная смесь Н2:N2=3:1.
Н2 получ. по 2-м способам.
По 1-му: выделяется по методу фракционированной конденсации подходящего Н2-содержащегося газа в коксовом газе, т.к. имеет среди них самую низкую t кип:
T(кип.)H2 = -252,60С;
Содержание Н2 в коксовом газе 58-60%.
По 2-му получение Н2 основано на переработке предельных и непредельных углеводородов и СО с помощью водяного пара.
СН4+Н2О=СО+3Н2, +206;
СО+Н2О=СО2+Н2, -41(1)
Эти процессы называютсяся конверсией ПГ и конверсией СО проводят при повышенных t и Кt.Для реализации конверсионного способа получения Н2 пригодно всевозможное С-содержащее сырьё (тв., ж., г.).
Сырьё:1).кокс, уголь, сланец. 2). Нефть и её производные 3). ПГ, попутный газ нефтедобычи, газопереработки нефти. Применение того или иного сырья обусловлено его стоимостью и наличием в данном регионе. При наличие ТВ. сырья и дефиците ПГ Н2 получают через генераторные СО-содержащие газы.
А). Воздушный газ получают подачей воздуха в раскаленный слой топлива:
С+О2 = СО2, --409, (2)
С+СО2=2СО,+161(3)
СО+Н2О = СО2 +Н2, (СО - удаляется, Н2-остается в газ. смеси)
Для (2) lgK=lgPco2/Рсо2 , для максимального выхода СО - 33% t процесса надо поддерживать 1000-1200ОС.
Б) через водяной газ он образуется при взаимодействии раскаленного слоя топлива с водяным паром:
С+Н2О = СО+Н2,+118, (4) расход Q на эту реакцию компенсируется сжиганием части топлива по (2)
Т. обр. получение водяного газа - периодический процесс и состоит из 2-х фаз:
1. фаза газования - подача пара в раскаленный слой топлива (4);
2. фаза горячего дутья - подача воздуха и при этом идет реакция (2).
Наибольший выход СО 38% и Н2 50% достигается при 900-9500С.
Недостатки: периодичность работы генератора; необходимость применения дорогого кокса или антрацита.
Конверсия ПГ т.е. СН4 и его гомологов является основным промышленным методом получения Н2 и технологических газов для синтеза NH3, спиртов, топлив.
В ПГ д. содержатся:
СН4 - 85,9-98,7;
С2Н60,15-5;
С3Н8 0,06-1,5;
С4Н100,02-0,7;
С5Н120-0,5;
СО20,08-3,5;N20-5.
Примеси в ПГ: общая масс. концентрация.S-соед-й (в пересч. на S) 80мг/м3; масс. концентрация газового конденсата (жидкие у/в) н.б.15г/м3; масс. концентрацияя мех. примесей н.б.1мг/м3
В технологическом воздухе д.б., мг/м3:
сернистых соединений (в пересч. на S) н.б.0,05;
Хлор и др. галлоиды (в пересч. на Cl) н.б.0,01;
Фосфаты (в пересч. на РО43- н.б.0,01;
масло и примеси - отсутствуют.
1.3 Тепловой баланс.
Исх. данные.
1) состав газа на выходе из конвектора - см.мат.баланс.
2) Т газа на выходе – 440 о С.
3) потери тепла принимаем 0,5 % от прихода.
Цель расчета: определение потоков прихода и расхода тепла, определение темп. ПГС на входе в конвертор.
Условия теплового баланса:
Qприх = Qрасх.
Ур-е теплового баланса:
Q1 + Q2 = Q3 + Q4,
где Q1- физическое тепло ПГС на входе в конвертор, Q2 – тепло экзотермической р-ции конверсии СО, Q3 – физическое тепло ПГС на выходе из конвектора, Q4 – потери.
Обоз-м tвх – темп-ра ПГС на входе, она определяется по методу итераций. Сначала задают некоторую tвх, вычисляют при этой темп-ре среднюю теплоемкость ПГС, рассчитывают все потоки тепла и используя условие теплого баланса определяют tвх. Если принятая tвх отличается от рассчитанной tвх больше, чем на 0,5 ОС следует повторить расчет снова, приняв др. tвх и т.д. до тех пор, пока не выполнится условие: | tвх принятая – tвх рассчитанная | £ 0,5 ОС.
Шаг I. Примем tвх = 380 ОС.
1) выразим Q1:
Q1 = Vct, V = 158,8 м3 (из мат.б-са). Рассчитываем средние теплоемкости ПГС при 380 ОС (653 К), с = 1,4421 кДж/м3К.
Отсюда Q1 = 4421*158,8* tвх = 229,01 * tвх.
2) Рассчитываем Q2, воспользуемся термохимическим уравнением реакции конверсии СО. Из ур-я следует, что если реагирует 22,4 л (0,0224 м3) СО, то выделяется 41 кДж тепла, но фактичеки реагирует 8,83 м3 СО,
тогда Q2 = 8,83*41/0,0224 = 16162,1 кДж.
3) Выразим Qприх:
Qприх = 16162,1+229,01 * tвх.
4) рассчитаем Q3:
Q3 = Vct.
Рассчитаем среднюю теплоемкость:
c = 1,302*0,4143 + 1,341*0,1397 + 1,351*0,0243 + 1,995*0,1034 + 2,107*0,0019 + 0,928*0,0018 + 0,3147*1,588 = 1,471 кДж/м3К.
Отсюда Q3 = 1,4711*158,8*440 = 102788,7 кДж.
5) Выразим Q4:
Q4 = 0,005*Qпр = 0,005*(16162,1+229,01* tвх) = 80,81+1,145* tвх кДж.
6) Запишем уравнение теплового баланса и рассчитаем
tвх. 16162,1+229,01* tвх=102788,7+80,81+1,147*tвх. Отсюда tвх = 380,52 ОС.
Проверяем условие: | 380 – 380,52 | > 0,5 ОС Условие не выполняется. Шаг II:…
30.Разделение воздуха методом ректификации. Диаграмма равновесия в системе N2- O2 при атмосферно. давлении.
Для синтеза аммиака азот получают низкотемпературной ректификацией жидкого воздуха при высоком давлении. Следовательно была разработана теория глубокого охлаждения (ß100С).
Основы глубокого охлаждения. Существуют 2 метода получения низких температур применительно к глубокому охлаждению.
1). Расширение газа без совершения внешней работы в специальном расширительном вентиле с использованием эффекта Дж. Томсона., т.е используется метод дросселирования (дроссельный эффект). При дросселировании резко понижать Р нельзя, а в детандоре можно.
Эффект дросселирования – при расширении сжатого воздуха до более низкого давления без совершения внешней работы и без обмена теплотой с окруающей средой температура газа понижается. Есть дифференциальный и интегральный дроссельный эффекты. Дифференциальный - отношение бесконечно малого изменения темп-ры к вызывающему его бесконечно малому уменьшению давления газа. Практически дифференциальным дросселирующим эффектом считают изменение темп-ры при падении давления на 0,1 Мпа, что дает уменьшение температуры 0,25 ОС. Интегральный - соответствует изменению темп-ры при больших изменениях давления. Дроссельный эффект Дж Томсона может быть положительным (если газ при дросселировании охлаждается) и отрицательным.
2). Расширение газа с совершением внешней работы в специальной машине - детандоре.
Детандирование - основано на явлении охлаждения г при его расширении с совершением внешней работы. Расширение идет без обмена теплотой и совершаемая при этом работа производится за счет изменения (уменьшения) внутренней энергии газа. При расширении достигается больший эффект охлаждения, чем при дросселировании. При расширении в области между сравнительно невысокими давлениями эффективно дросселирование, а если перепад давлений при расширении велик или оно идет при выских температурах лучше детандирование. Рис
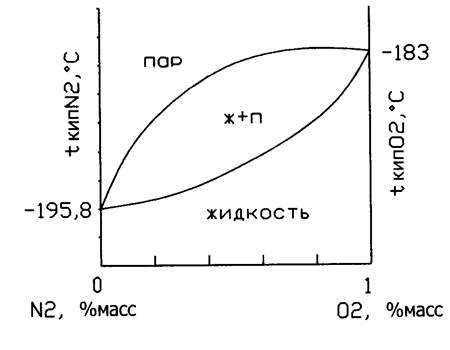
с его исп-ем опред-ют число теор тарелок и с исп-ем кпд действит тарелок. Кроме того здесь нет азеотропов и м разделить смесь на кислород и азот.
Чем выше давл-е, тем меньше разница м/д составом пара и ж-ю, и она полностью исчез-ет при достиж-и крит тем-ры, отсюда д/раздел-я воз-ха на О2 и N2 нужно вести при пониж-ых тем-рах.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.