












Вторая особенность, характеризующая процессы белкового метаболизма, заключается в зависимости белков от их поступле-ния в организм извне.
Существует десять так называемых «незаменимых» амино-кислот, которые не синтезируются в организме человека, а обяза-тельно должны поступать извне, иначе полноценный синтез белков в организме будет нарушен.
Это: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин.
4
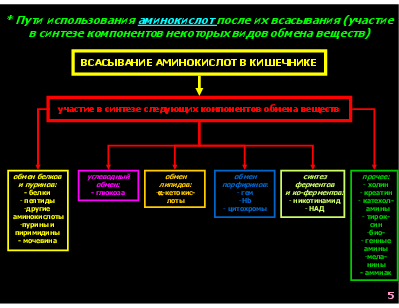
* Пути использования аминокислот после их всасывания (участие в синтезе компонентов некоторых видов обмена веществ)
ВСАСЫВАНИЕ АМИНОКИСЛОТ В КИШЕЧНИКЕ
участие в синтезе следующих компонентов обмена веществ
углеводный обмен: - глюкоза
5
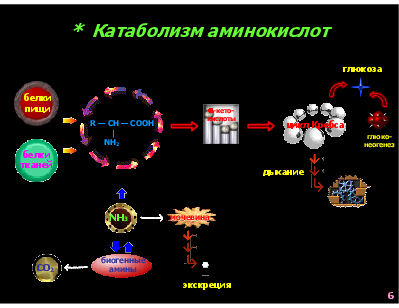
* Катаболизм аминокислот глюкоза
белки пищи
-кето- кислоты
R — CH — COOH | NH2
цикл Кребса
глюко- неогенез
белки тканей
дыхание
NH3
мочевина
биогенные амины
СО2
экскреция
6
* Типы белкового синтеза
1. Синтез роста, связанный с развитием организма в целом. Он заканчивается, примерно, к двадцати пяти годам, то есть к моменту прекращения физиологического роста.
2. Стабилизирующий синтез, определяющий репарацию белков, утраченных в процессе диссимиляции и лежа-щий, таким образом, в основе их самообновления на протяжении всей жизни.
3. Регенерационный синтез, проявляющийся в период восстановления после белкового истощения, крово-потерь и т.д.
4. «Функциональный» синтез – образование белков, несущих специфические функции: ферментов, гемогло-бина и др.
7
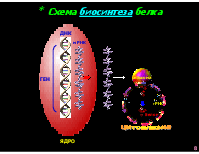
* Схема биосинтеза белка
ДНК
мРНК
рибосома
ГЕН
тРНК
белок
цитоплазма
ЯДРО
8
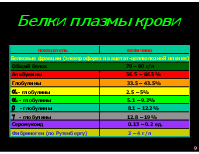
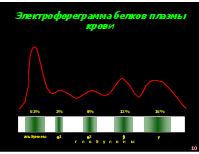
Белки плазмы крови показатель величина
Белковые фракции (электрофорез на ацетат-целлюлозной пленке)
Общий белок 70 – 90 г/л
Альбумины 56.5 – 66.5%
Глобулины 33.5 – 43.5%
1- глобулины 2.5 – 5%
2 - глобулины 5.1 – 9.2%
- глобулины 8.1 – 12.2%
- глобулины 12.8 – 19%
Серомукоид 0.13 – 0.2 ед.
Фибриноген (по Рутенбергу) 2 – 4 г/л
9
Электрофореграмма белков плазмы крови
62% 2% 8% 12% 16%
альбумины 1 2 г л о б у л и н ы
10
* Виды голодания
Абсолютное голодание - полное прекращение по-ступления в организм пищи и воды.
Полное голодание – полное отсутствие приема пищи при сохранении приема воды.
Неполное голодание – это состояние, характеризую-щееся тем, что калорийность принимаемой пищи не покрывает всех энергетических затрат организма.
Частичное голодание – калорийность пищи пол-ностью покрывает энергетические затраты организма, однако, в составе пищи отсутствуют или имеются в недостаточном коли-честве те или иные питательные вещества (белки, жиры, углево-ды, витамины, минеральные вещества и др.).
11
*Периоды полного голодания
Периоды голодания
Обеспечение энергетических потребностей
Дыхательный коэффициент
Длительность
Первый (приспособи- тельный)
1.0
В основном за счет распада углеводов
2 – 4 суток
Второй (стационар- ный)
В основном за счет распада жиров и частично - белков
0.7
55 – 60 суток
Третий (терминаль- ный)
В основном за счет распада белков
1.0
2 –3 суток
12
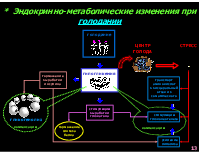
* Эндокринно-метаболические изменения при голодании голодание
ЦЕНТР ГОЛОДА
СТРЕСС
гипогликемия
торможение выработки инсулина
транспорт аминокислот в висцеральный отсек из соматического
стимуляция выработки глюкагона
стимуляция глюконеогенеза гликогенолиз
компенсация
торможение синтеза белка компенсация усиление липолиза
13
Белковая и белково-калорийная недостаточность
Белково-калорийная недостаточность у де-тей, распространенная в ряде стран Африки (квашиоркор), представляет собой алимен-тарный маразм, связанный с неполноценным питанием после прекращения вскармлива-ния ребенка грудным молоком и переходом его, в основном, на растительно-углеводную диету. Такие дети отстают в росте и психи-ческом развитии, у них обнаруживается ис-тончение, поредение и депигментация волос, диффузная депигментация кожи, слоисто-пигментированный дерматоз, мышечное ис-тощение, гепатомегалия. Наблюдаются ха-рактерные изменения внешнего облика: яв-ления общего истощения, относительное увеличение мозговой части черепа, печень, выступающая из-под реберной дуги. Разви-вается жировая дистрофия печени, возника-ют «голодные» (онкотические) отеки.
14
* АМИЛОИДОЗ
Амилоидоз представляет собой одну из форм нарушения белково-го обмена, при которой в межтканевых щелях, по ходу сосудов и в их стенке, около мембран железистых органов откладывается особое веще-ство – амилоид, имеющее белково-полисахаридную природу. Амилоид резко нарушает функцию органов по месту своего отложения и может приводить не только к возникновению в организме тяжёлых расстрой-ств, связанных с патологией этих органов, но и к гибели последних и ор-ганизма в целом. Различают три формы амилоидоза: - идиопатический (имеющий наследственный генез); - вторичный (наиболее часто встречающаяся форма); - старческий.
15
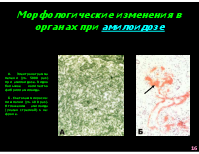
Морфологические изменения в органах при амилоидозе
А. Электронограмма печени (ув. 5000 раз) при амилоидозе. Видно большое количество фибрилл амилоида. Б. Световая микроско-пия почки (ув. 100 раз). Отложения амилоида (указан стрелкой) в не-фроне.
16
Виды амилоида и связанные с ними формы амилоидоза
Предшественник амилоида
Заболевание
Предшествующие заболевания
Локализация
Хроническое воспаление Опухоли Идиопатическое возникновение
Почки Печень Селезенка Надпочечники
AA-амилоидоз
AA
Почки Печень Селезенка Мышечная ткань Кровеносные сосуды
Плазмоцитома Иммуноцитома Идиопатическое возникновение
AL
AL-амилоидоз
АА – сывороточный амилоид А (острофазный протеин); АL – амилоидо-иммуноглобулин с легкими цепями. В таблице приведены две формы амилоидоза, составляющие его основной пул. Кроме указанных, встречаются еще и редкие формы с другим составом амилоида.
17
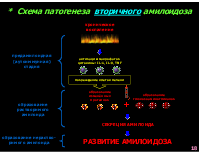
* Схема патогенеза вторичного амилоидоза
хроническое воспаление
предамилоидная (аутоиммунная) стадия
активация макрофагов цитокины: IL-1, IL-8, TNF
повреждение клеток печени
образование изменённых протеинов
образование глюкозоаминогликанов
+
образование растворимого амилоида
СЕКРЕЦИЯ АМИЛОИДА
образование нераство- римого амилоида
РАЗВИТИЕ АМИЛОИДОЗА
18
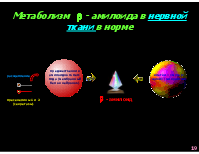
Метаболизм - амилоида в нервной ткани в норме
предшественник амилоидного пеп- тида (мембранный белок нейронов)
клетки – «мусор- щики» (микроглия)
расщепление
- амилоид
пресенелины 1 и 2 (секретазы)
19
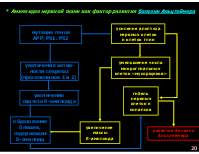
* Амилоидоз нервной ткани как фактор развития болезни Альцгеймера
усиление апоптоза нервных клеток и клеток глии
мутация генов АРР, PS1. PS2
уменьшение числа микроглиальных клеток «мусорщиков»
увеличение актив- ности секретаз (пресенелинов 1 и 2)
гибель нервных клеток и синапсов
увеличение синтеза ß-амилоида
образование бляшек, содержащих ß-амилоид
увеличение массы ß-амилоида
развитие болезни Альцгеймера
20
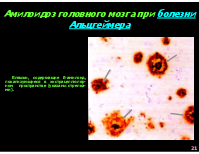
Амилоидоз головного мозга при болезни Альцгеймера
Бляшки, содержащие ß-амилоид, локализующиеся в экстрацеллюляр-ном пространстве (указаны стрелка-ми).
21
Раздел 2
Нарушения пуринового обмена Этиология и патогенез подагры
22
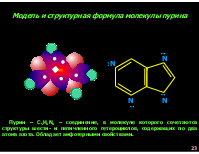
Модель и структурная формула молекулы пурина
:
N
N
:
:
N
N
:
Пурин – C5H4N4 – соединение, в молекуле которого сочетаются структуры шести- и пятичленного гетероциклов, содержащих по два атома азота. Обладает амфотерными свойствами.
23
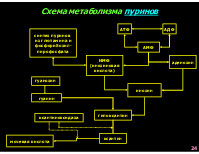
Схема метаболизма пуринов
АТФ
АДФ
синтез пуринов из глютамина и фосфорибозил- пирофосфата
АМФ
ИМФ (инозиновая кислота)
аденозин
гуанозин
инозин
гуанин
гипоксантин
ксантиноксидаза
ксантин
мочевая кислота
24
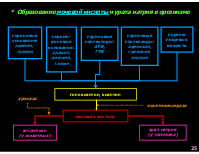
* Образование мочевой кислоты и урата натрия в организме
пуриновые основания: аденин, гуанин
пирими- диновые основания: урацил, цитозин, тимин
пуриновые нуклеотиды: АТФ, ГТФ
пуриновые нуклеозиды: аденозин, гуанозин, инозин
пурины пищевых веществ
гипоксантин, ксантин
уриказа
ксантиноксидаза
мочевая кислота
аллантоин (у животных)
урат натрия (у человека)
25
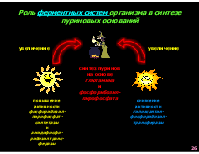
Роль ферментных систем организма в синтезе пуриновых оснований
увеличение увеличение
синтез пуринов на основе глютамина и фосфорибозил- пирофосфата
повышение активности фосфорибозил- пирофосфат- синтетазы и амидофосфо- рибозилтранс- феразы
снижение активности гипоксантин- фосфорибозил- трансферазы
26
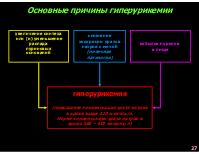
Основные причины гиперурикемии
снижение экскреции уратов натрия с мочой (почечная патология)
избыток пуринов в пище
увеличение синтеза или (и) уменьшение распада пуриновых оснований
гиперурикемия (повышение концентрации урата натрия в крови выше 420 мкмоль/л. Норма концентрации урата натрия в крови 360 – 415 мкмоль/л)
27
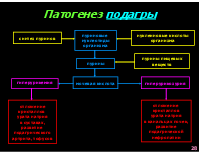
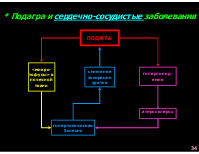
Патогенез подагры
пуриновые нуклеотиды организма
нуклеиновые кислоты организма
синтез пуринов
пурины пищевых веществ
пурины
мочевая кислота
гиперурикозурия
гиперурикемия
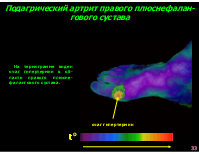
отложение кристаллов урата натрия в суставах, развитие подагрического артрита, тофусов
отложение кристаллов урата натрия в канальцах почек, развитие подагрической нефропатии
28
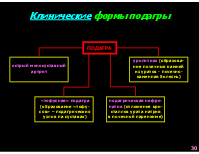
* Классификация форм подагры по этиопатогенетическому принципу
ПЕРВИЧНАЯ ПОДАГРА: - метаболическая (наследственная). Передающееся по наследству изменение активности некоторых ферментных систем, в результате чего нарушается пуриновый метаболизм и возникает гиперпродукция мочевой кислоты. - почечная (ретенционная). Генетически обусловленное уменьшение экскреции мочевой кислоты почками. ВТОРИЧНАЯ ПОДАГРА: - Нарушение пуринового обмена и обмена мочевой кислоты, вызванное
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.