В присутності надлишку іонів CN-, утворених внаслідок дисоціації КСN, рівновага зміщується у бік недисоційованого комплексу, і кількістю CN-, утворених при дисоціації [Ag(CN)2]-, можна нехтувати.
Тоді [CN-] = [КСN] = 0,01 моль/л.
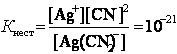 |
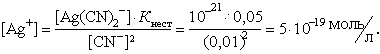 |
Відповідь: концентрація іонів Ag + дорівнює 5.10-19 моль/л.
Питання і задачі
1. Які сполуки називаються комплексними? Як можна їх одержати?
2. Записати рівняння одержання сполук і назвати їх: Na2[ Zn(OH)4 ] ;
[Ag(NH3)2]NO3 ; K4 [Fe(CN)6] ; [Cu(H2O)4]SO4.
3. Визначити внутрішню і зовнішню сфери , ліганди, комплексоутворювачі в сполуках : [PdCl(H2O)(NH3)2]Cl; [CoCN(H2O)(NH3)4]Br2; [Ni(NH3)6]Cl2 ; K2[Cu(CN)4 ]; K2[Pt(OH)5Cl].
4. Координаційне число OS4+ і Ir4- дорівнює 6. Складіть координаційні формули і напишіть рівняння дисоціації в розчині таких комплексних сполук:
2NaNO2 . OsCl4; 2RbCl . IrCl4; OsBr4 . Ca(NO3)2; 2KCl . Ir(NO3)4 .
5. Є комплексна сіль Ba(CN)2 . Cu(CNS)2 . При дії розчину H2SO4 весь барій осаджується в вигляді BaSO4. Напишіть координаційну формулу цієї солі. Скільки комплексної солі було в розчині, якщо взаємодіяло 0,125 л 0,25 н H2SO4 .
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.