Составим энергетический баланс цикла. При образовании контакта выделяется интегральная теплота адсорбции в зоне контакта. - δq . При перемещении контакта вдоль кристаллита изменение энергии нет. При разрыве контакта затрачивается работа δА= δq. На пути трения 1 м этот цикл повторится 1/L раз (Напомним L- длина кристаллита). Отсюда работа разрыва адгезионных связей составит Aа =q/L. Суммарная работа силы трения на пути 1 м включает кроме работы разрыва адгезионных работу образования продуктов изнащивания.
А= q/L+6nIσ/L
А коэффициент трения при граничном трении
f=1/LP(q+6nIσ)
Здесь q- теплота адсорбции в микропоре, которая в два раза выше, чем на плоской поверхности, L- размер кристаллита на поверхности трения; Р – давление; n≈103 –коэффициент рекомбинации разоравнных когезионных связей, I- линейная интенсивность изнашивания:; σ – поверхностное натяжение
Напомним, что условием существования смазочного слоя на контакте является равенство его противодавления максимальному давлению на контакте. Иначе адсорбированные молекулы будут выдавлены из зоны контакта, поскольку молекулы свободно перемещаются вдоль поверхности. Величину противодавления смазочного слоя, как и в случае трения графита, можно найти интегрированием уравнения Пойнтинга. Это уравнение было выведено из условий фазового равновесия адсорбционного слоя и газовой фазы.
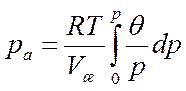
Здесь ра – противодавление смазочного слоя;Vж- мольный объем присадки в жидком состоянии;θ – степень заполнения микропоры на контакте; р – парциальное давление присадки в газовой фазе.
Давление на контакте может быть рассчитано по формулам Демкина для упругого или пластического контакта.
Адсорбция из растворов существенно отличается от адсорбции из газовой фазы. При адсорбции из растворов молекулы компонентов раствора в результате взаимодействия с атомами или молекулами поверхности твердого тела удерживаются на границе раздела фаз. Различия в интенсивности взаимодействия растворенного молекул растворенного вещества и растворителя с поверхностью адсорбента приводят к тому, что концентрация присадки у поверхности раздела фаз повышается, в то же время концентрация этих веществ в растворе снижается. Таким образом, увеличение концентрации присадки на поверхности адсорбента является следствием различия величин энергии взаимодействия молекул присадки и масел с адсорбентом. Помимо различий в энергии взаимодействия молекул компонентов раствора с адсорбентом, на величину адсорбции влияет энергия взаимодействий молекул растворенного вещества с молекулами растворителя. В общем виде это проявляется в растворимости присадки в масле.
Схематически баланс энергетических взаимодействий, приводящих к избирательной адсорбции присадки, можно представить в виде равенства
Еа,м=Ea – Eм - Ер (4.1)
где Еа,м — энергия адсорбция молекул присадки из масла, Ea —энергия адсорбционного взаимодействия молекул этого вещества при отсутствии молекул растворителя и других компонентов раствора; Eм — энергия взаимодействия молекул растворителя с адсорбентом; Ер — энергия взаимодействия молекул присадки молекулами масла в растворе.
При адсорбции молекул газов или паров степень заполнения ими поверхности адсорбента зависит от величины равновесного давлении — от концентрации молекул в газовой фазе. При адсорбции из растворов поверхность адсорбента, погруженного в жидкость, всегда полностью покрыта молекулами компонентов раствора, т. е. относительная степень заполнения поверхности раздела фаз суммой молекул всех видов (θΣ ) всегда равна единице и не зависит от концентрации раствора. В адсорбированном слое происходят лишь перераспределение молекул компонентов раствора в соответствии с энергией их взаимодействия с адсорбентом. Поэтому для каждого из компонентов раствора относительная величина заполнения поверхности раздела фаз (θi )—отношение величины поверхности, занятой молекулами одного вещества, к общей величине поверхности раздела, является функцией равновесной концентрации раствора. Следовательно, отношение концентраций молекул присадки в адсорбированном слое и в равновесном растворе характеризует избирательность адсорбции присадки из масла. При отсутствии избирательности концентрация присадки в адсорбированном слое столь же мала, как и в масле.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.