




















Лекция 2.2
Механизм сухого трения
На предыдущем занятии мы узнали, что зависимость силы трения от нагрузки удовлетворительно описывается биномиальными законами Кулона
F=A+P/μ
F-сила трения, А-константа,Р – нагрузка, μ – коэффициент трения и Крагельского
. 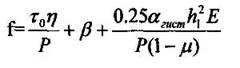
(2.1)
τ0 – константа -удельная адгезия (сила трения, отнесенная к площади контакта) и β – константы; (η – площадь фактического контакта; Р – нагрузка; α – декремент затухания; Е- модуль упругости; h1 – глубина внедрения; μ – коэффициент Пуассона.
По мнению и Кулона и Крагельского, трение вызывает взаимодействие на площади фактического контакта. Это – «сцепленность» или удельная адгезия. Какие же силы вызывают «сцепленность» или удельную адгезию.
При внутреннем трении разрыв и рекомбинация связей происходит внутри тела. Это трение в жидкостях, газах и твердых телах при пластической деформации.
При внешнем трении твердых тел разрыв и рекомбинация связей происходит как на границе контактирующих тел, так и под их поверхностью вызывая изнашивание.
Для внешнего трения необходимо, чтобы прочность фрикционной связи была ниже, чем прочность контактирующих тел. Иначе каждый акт контактирования будет сопровождаться вырыванием материала из области контакта или схватыванием.
Прочность фрикционной связи определяется энергией связей на контакте и чилом этих связей
Взаимодействие поверхностей на контакте может осуществляться за счет образования химических, металлических, а также ван-дер-ваальсовых (молекулярных) связей. Кроме перечисленных в принципе возможно также образование водородных связей, но их вклад обычно незначителен.
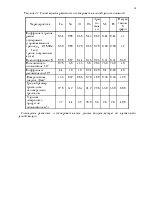
При образовании химических, металлических связей происходит перестройка электронных оболочек реагирующих атомов. При образовании молекулярных связей перестройка электронных оболочек не происходит. В таблицах 2-4 представлены энергии химических, металлических и молекулярных связей.
Табл.2.1 Энергия металлических связей.
|
Fe |
Ni |
Ti |
W |
Ta |
Nb |
|
|
Энергия связи, кДж.г/атом |
432 |
474 |
474 |
839 |
785 |
742 |
Табл.2.2 Энергия химической связи в соединениях
|
Соединение |
СО2 |
Н20 |
алкены |
алкены |
спирты |
спирты |
|
Связь |
С=О |
-ОН |
C-H |
C=C |
C=O |
О-Н |
|
Энергия связи, кДж/моль |
801 |
459 |
417 |
587 |
334 |
436,5 |
Табл.2.3 Энергия молекулярных связей
|
Соединение |
Н2О |
С6Н6 |
N2,жидк |
Cтеариновая к-та |
|
Энергия связи, Дж/моль |
41,97 |
29,3 |
0,28 |
40 |
Видно, что энергия металлических и химических связей на порядок выше, чем у молекулярных, поэтому при создании узлов трения следует принимать меры, исключающие условия их образования.
Химические и металлические связи
Обычно химические связи делят на: ионные или гетерополярные и гомеополярные или ковалентые. Химическая связь в металлах приближается по типу к ковалентной связи, но в некоторых отношениях сходна с ионной.
В настоящее время эта классификация типов химической связи представляется несколько условной. Она соответствует предельным случаям. В реальных веществах связь может иметь смешанный характер. К ионным или гетерополярным относятся галоидно-водородные соединения и галоидные соединения щелочных элементов: НС1, HBr, NaCl, NaBr и др. В этих, как и во всех других случаях ионной связи, каждому из атомов (или группе атомов) можно приписать определенное электронное строение, практически не зависящее от присутствия других атомов или групп атомов. Молекула NaCl, как и кристалл, состоит из ионов Na+ и С1-, обладающих электронным строением соответственно атомов Nа и Cl.
Гомеополярную связь образуют атомы азота, кислорода, углерода и др. неметаллических элементов. Но не любые два атома образуют при своем сближении молекулу. Для образования последней необходимо, чтобы при сближении соответствующих атомов происходило занятие электронами наиболее низких из тех энергетических уровней, которые возникают вместо уровней изолированных атомов. Только при этом условии уменьшение энергии электронов компенсирует происходящее при таком сближении возрастание энергии кулоновского отталкивания положительно заряженных ядер.
Металл в твердом состоянии представляет собой совокупность ионов, образующих кристаллическую решетку, и электронов проводимости, движущихся внутри решетки и взаимодействующих как с ионами, расположенными в узлах решетки, так и друг с другом. Металл можно рассматривать как своего рода гигантскую молекулу
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.