ХИМИЧЕСКАЯ СВЯЗЬ
ПОНЯТИЕ О ХИМИЧЕСКОЙ СВЯЗИ ЯВЛЯЕТСЯ ОДНИМ ИЗ ОСНОВОПОЛАГАЮЩИХ В СОВРЕМЕННОЙ ХИМИЧЕСКОЙ НАУКЕ.
«ХИМИЧЕСКАЯ СВЯЗЬ – ЯВЛЕНИЕ ВЗАИМОДЕЙСТВИЯ АТОМОВ, ОБУСЛОВЛЕННОЕ ПЕРЕКРЫВАНИЕМ ЭЛЕКТРОННЫХ ОБЛАКОВ СВЯЗУЮЩИХСЯ ЧАСТИЦ, КОТОРОЕ СОПРОВОЖДАЕТСЯ УМЕНЬШЕНИЕМ ПОЛНОЙ ЭНЕРГИИ СИСТЕМЫ (МОЛЕКУЛА, КОМПЛЕКС, КРИСТАЛЛ И Т.П.).»
В ОБРАЗОВАНИИ ХИМИЧЕСКОЙ СВЯЗИ МЕЖДУ АТОМАМИ ГЛАВНУЮ РОЛЬ ИГРАЮТ ЭЛЕКТРОНЫ, РАСПОЛОЖЕННЫЕ НА ВНЕШНЕЙ ОБОЛОЧКЕ И, СЛЕДОВАТЕЛЬНО, СВЯЗАННЫЕ С ЯДРОМ НАИМЕНЕЕ ПРОЧНО, ТАК НАЗЫВАЕМЫЕ ВАЛЕНТНЫЕ ЭЛЕКТРОНЫ. ИМЕННО ПОЭТОМУ СТРОЕНИЕ ВАЛЕНТНОЙ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ АТОМОВ ЯВЛЯЕТСЯ ВАЖНЕЙШИМ ФАКТОРОМ ПРИ ОБРАЗОВАНИИ ХИМИЧЕСКОЙ СВЯЗИ. НАИБОЛЬШЕЙ УСТОЙЧИВОСТЬЮ ОБЛАДАЮТ ВНЕШНИЕ ОБОЛОЧКИ ИЗ ДВУХ ИЛИ ВОСЬМИ ЭЛЕКТРОНОВ (БЛАГОРОДНЫЕ ГАЗЫ).
ХИМИЧЕСКАЯ СВЯЗЬ ХАРАКТЕРИЗУЕТСЯ ЭНЕРГЕТИЧЕСКИМИ И ГЕОМЕТРИЧЕСКИМИ ПАРАМЕТРАМИ.
I. ЭНЕРГЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА – ОПРЕДЕЛИТЕЛЬ ПРОЧНОСТИ СВЯЗИ. ЕЕ ВЕЛИЧИНА ОПРЕДЕЛЯЕТСЯ РАБОТОЙ, НЕОБХОДИМОЙ ДЛЯ РАЗРУШЕНИЯ СВЯЗИ, ИЛИ ВЫИГРЫШЕМ В ЭНЕРГИИ ПРИ ОБРАЗОАНИИ ВЕЩЕСТВА ИЗ ОТДЕЛЬНЫХ АТОМОВ. НАПРИМЕР,
1. ЭНЕРГИЯ СВЯЗИ Н-Н В МОЛЕКУЛЕ ВОДОРОДА РАВНА 435 кДж/моль. ЭТО ЗНАЧИТ, ЧТО ПРИ ОБРАЗОВАНИИ 1 МОЛЬ ГАЗООБРАЗНОГО ВОДОРОДА ИЗ ИЗОЛИРОВАННЫХ АТОМОВ ВЫДЕЛЯЕТСЯ 435 кДж /моль :
Н+Н = Н2 + 435 кДж/моль.
ТАКОЕ ЖЕ КОЛИЧЕСТВО ЭНЕРГИИ ДОЛЖНО БЫТЬ
ЗАТРАЧЕНО НА РАСПАД 1 МОЛИ ВОДОРОДА ДО
АТОМАРНОГО СОСТОЯНИЯ.
ПРИМЕР 2.
С + 4Н = СН4 + 1647 кДж/моль
2Н + О = Н2О + 924 кДж/моль
ОТСЮДА, СРЕДНЯЯ ЭНЕРГИЯ СВЯЗИ С-Н РАВНА :
1647 : 4 = 412 кДж/моль
А СРЕДНЯЯ ЭНЕРГИЯ СВЯЗИ О-Н РАВНА :
924:2 = 462 кДж /моль.
II. ДЛИНА ХИМИЧЕСКОЙ СВЯЗИ
ПОД ДЛИНОЙ СВЯЗИ ПОДРАЗУМЕВАЮТ РАССТОЯНИЕ МЕЖДУ ЦЕНТРАМИ ЯДЕР АТОМОВ В МОЛЕКУЛЕ (ИЛИ КРИСТАЛЛЕ), КОГДА СИЛЫ ПРИТЯЖЕНИЯ УРАВНОВЕШЕНЫ СИЛАМИ ОТТАЛКИВАНИЯ И ЭНЕРГИЯ СИСТЕМЫ МИНИМАЛЬНА.
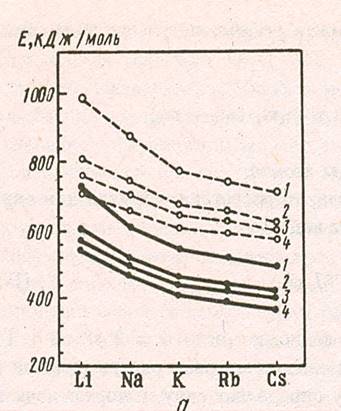
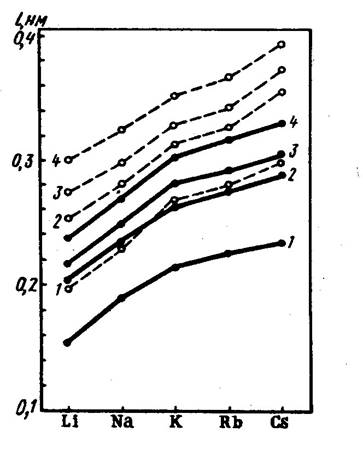
ИЗМЕНЕНИЕ ЭНЕРГИИ СЯЗИ ИЗМЕНЕНИЕ ДЛИНЫ ХИМИЧЕСКОЙ
В РЯДУ ГАЛОГЕНИДОВ ЩЕЛОЧНЫХ СВЯЗИ ДЛЯ ГАЛОГЕНИДОВ ЩЕЛОЧ-
МЕТАЛЛОВ И КРИСТАЛЛОВ НЫХ МЕТАЛЛОВ
![]()
![]()
![]()
![]()
![]() 1-ФТОРИДЫ; 2-ХЛОРИДЫ;
- КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ
1-ФТОРИДЫ; 2-ХЛОРИДЫ;
- КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ
![]() 3-БРОМИДЫ; 4-ИОДИДЫ
- ПАРООБРАЗНОЕ СОСТОЯНИЕ
3-БРОМИДЫ; 4-ИОДИДЫ
- ПАРООБРАЗНОЕ СОСТОЯНИЕ
1-ФТОРИДЫ; 2-ХЛОРИДЫ;
3-БРОМИДЫ; 4-ИОДИДЫ
ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
1. КОВАЛЕНТНАЯ СВЯЗЬ (КС)
КОВАЛЕНТНУЮ СВЯЗЬ ОБРАЗУЮТ АТОМЫ (ИЛИ ГРУППЫ АТОМОВ), НА ВАЛЕНТНЫХ ОРБИТАЛЯХ КОТОРЫХ ИМЕЮТСЯ НЕСПАРЕННЫЕ ЭЛЕКТРОНЫ. ДРУГИМИ СЛОВАМИ, СВЯЗЬ, ОСУЩЕСТВЛЯЕМАЯ ЗА СЧЕТ ОБРАЗОВАНИЯ ЭЛЕКТРОННЫХ ПАР, В ОДИНАКОВОЙ МЕРЕ ПРИНАДЛЕЖАЩИХ ОБОИМ АТОМАМ, НАЗЫВАЕТСЯ КОВАЛЕНТНОЙ (МЕЖДУ ОДИНАКОВЫМИ АТОМАМИ)
![]() H’ +
H’’ H2
H’ +
H’’ H2



 r12
r12
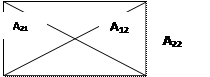 |
|
|
Рис. ВЗАИМОДЕЙСТВИЕ ДВУХ АТОМОВ ВОДОРОДА. КАЖДЫЙ ЭЛЕКТРОН ПРИТЯГИВАЕТСЯ ЯДРОМ СОБСТВЕННОГО АТОМА (А11, А12) И ЯДРОМ СОСЕДНЕГО АТОМА (А12, А21). КРОМЕ ТОГО, СУЩЕСТВУЕТ ОТТАЛКИВАНИЕ МЕЖДУ ЭЛЕКТРОНАМИ (r12) И ДВУМЯ ЯДРАМИ R12.
КОВАЛЕНТНАЯ СВЯЗЬ МОЖЕТ ВОЗНИКАТЬ НЕ ТОЛЬКО МЕЖДУ ОДИНАКОВЫМИ, НО И МЕЖДУ РАЗНЫМИ АТОМАМИ. НАПРИМЕР, ОБРАЗОВАНИЕ МОЛЕКУЛЫ НСlИЗ АТОМОВ ВОДОРОДА И ХЛОРА ПРОИСХОДИТ ТАКЖЕ ЗА СЧЕТ ОБЩЕЙ ПАРЫ ЭЛЕКТРОНОВ. ОДНАКО ЭТА ПАРА В БОЛЬШЕЙ МЕРЕ ПРИНАДЛЕЖИТ АТОМУ ХЛОРА НЕЖЕЛИ АТОМУ ВОДОРОДА, ПОСКОЛЬКУ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ХЛОРА ГОРАЗДО БОЛЬШЕ ЧЕМ У ВОДОРОДА. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ – ЭТО СПОСОБНОСТЬ АТОМА ПРИТЯГИВАТЬ К СЕБЕ ВАЛЕНТНЫЕ ЭЛЕКТРОНЫ ДРУГИХ АТОМОВ.
РАЗНОВИДНОСТЬ КОВАЛЕНТНОЙ СВЯЗИ, ОБРАЗОВАННОЙ ОДИНАКОВЫМИ АТОМАМИ, НАЗЫВАЮТ НЕПОЛЯРНОЙ, А ОБРАЗОВАННОЙ РАЗНЫМИ АТОМАМИ – ПОЛЯРНОЙ (ПРИ ПОЛНОМ СМЕЩЕНИИ ПЕРЕХОДИТ В ИОННУЮ СВЯЗЬ).
ПОЛЯРНОСТЬ СВЯЗИ КОЛИЧЕСТВЕННО ОЦЕНИВАЕТСЯ ДИПОЛЬНЫМ МОМЕНТОМ μ, КОТОРЫЙ ЯВЛЯЕТСЯ ПРОИЗВЕДЕНИЕМ ДЛИНЫ ДИПОЛЯ ℓ -РАССТОЯНИЯ МЕЖДУ ДВУМЯ РАВНЫМИ ПО ВЕЛИЧИНЕ И ПРОТИВОПОЛОЖНЫМИ ПО ЗНАКУ ЗАРЯДАМИ +q И –q – НА АБСОЛЮТНУЮ ВЕЛИЧИНУ ЗАРЯДА q:
μ = ℓ· q
ПРИНЯТО СЧИТАТЬ, ЧТО ДИПОЛЬНЫЙ МОМЕНТ ЯВЛЯЕТСЯ ВЕЛИЧИНОЙ ВЕКТОРНОЙ И НАПРАВЛЕН ПО ОСИ ДИПОЛЯ ОТ ОТРИЦАТЕЛЬНОГО ЗАРЯДА К ПОЛОЖИТЕЛЬНОМУ.
ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ
![]()
![]()
![]()
![]() Н H
+
Н H
+
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Н N: +
H+HNH где
- свободная 1s-
Н N: +
H+HNH где
- свободная 1s-
HH орбиталь иона водорода
МЕХАНИЗМ ЗАКЛЮЧАЕТСЯ В ТОМ, ЧТО КОВАЛЕНТНАЯ СВЯЗЬ ОБРАЗУЕТСЯ В РЕЗУЛЬТАТЕ ПЕРЕХОДА УЖЕ СУЩЕСТВУЮЩЕЙ ЭЛЕКТРОННОЙ ПАРЫ ДОНОРА В ОБЩЕЕ ПОЛЬЗОВАНИЕ ДОНОРА И ДРУГОГО АТОМА – АКЦЕПТОРА, ПРЕДОСТАВЛЯЮЩЕГО ДЛЯ ЭТОЙ ПАРЫ СВОБОДНУЮ ОРБИТАЛЬ.
2. ИОННАЯ СВЯЗЬ
ИОННАЯ СВЯЗЬ – ЭЛЕКТРОСТАТИЧЕСКОЕ ПРИТЯЖЕНИЕ МЕЖДУ ИОНАМИ, ОБРАЗОВАННЫМИ ПУТЕМ ПРАКТИЧЕСКИ ПОЛНОГО СМЕЩЕНИЯ ЭЛЕКТРОННОЙ ПАРЫ К ОДНОМУ ИЗ АТОМОВ. ИОННАЯ СВЯЗЬ – ПРЕДЕЛЬНЫЙ СЛУЧАЙ ПОЛЯРНОЙ КОВАЛЕНТНОЦ СВЯЗИ.
СПОСОБНОСТЬ ОБРАЗОВАНИЯ ПРОСТЫХ ИОНОВ ОБУСЛОВЛЕНА ЭЛЕКТРОННОЙ (ОРБИТАЛЬНОЙ) КОНФИГУРАЦИЕЙ ИХ АТОМОВ, А ТАКЖЕ ВЕЛИЧИНАМИ ИХ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ, ЭНЕРГИЕЙ ИОНИЗАЦИИ И СРОДСТВА К ЭЛЕКТРОНУ.
ЛЕГЧЕ ВСЕГО КАТИОНЫ ОБРАЗУЮТ ЭЛЕМЕНТЫ С МАЛЫМИ ЭНЕРГИЯМИ ИОНИЗАЦИИ
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.