ТАКИМ ОБРАЗОМ, ЗНАЯ ПЛОТНОСТЬ ВЕЩЕСТВА И МАССУ ОДНОЙ МОЛЕКУЛЫ, МОЖНО ОПРЕДЕЛИТЬ ЧИСЛО МОЛЕКУЛ В 1М3 ВЕЩЕСТВА:
N = ![]()
4. ДАВЛЕНИЕ. ЕДИНИЦЫ ДАВЛЕНИЯ – ПАСКАЛЬ- ЭТО ТАКОЕ ДАВЛЕНИЕ, КОТОРОЕ ПРОИЗВОДИТ СИЛА В 1 Н (НЬЮТОН) НА 1 М2 (1Н/М2): ОБОЗНАЧАЕТСЯ Па
1Па = 1Н/М2
1 гПа (ГЕКТАПАСКАЛЬ)= 100 Па
1000 Па = 1 кПа
ДАВЛЕНИЕ :P![]() , где Р-давление, F - сила
, где Р-давление, F - сила
S – площадь
ПРИМЕНЯЮТСЯ ВНЕСИСТЕМНЫЕ ЕДИНИЦЫ ДАВЛЕНИЯ :
1 мм.рт.ст.≈ 133,3 Па
НОРМАЛЬНОЕ АТМОСФЕРНОЕ ДАВЛЕНИЕРАВНО 101325 Па ИЛИ 1013 гПа, ИЛИ 0,1 Мпа, или 1 атмосфера, ИЛИ 760 мм.рт.ст.
5. КОЛИЧЕСТВО ТЕПЛОТЫ. ЕДИНИЦЫ КОЛИЧЕСТВА ТЕПЛОТЫ – ДЖОУЛЬ (Дж), ИЛИ кДж ВМЕСТО РАНЕЕ ИСПОЛЬЗОВАННОЙ КАЛОРИИ (КАЛ.) :
1 КАЛ= 4,19 Дж
6. ЭНЕРГИЯ ТОПЛИВА. УДЕЛЬНАЯ ТЕПЛОТА СГОРАНИЯ ТОПЛИВА – КОЛИЧЕСТВО ТЕПЛОТЫ, ВЫДЕЛЯЮЩЕЕСЯ ПРИ ПОЛНОМ СГОРАНИИ ТОПЛИВА МАССОЙ 1 КГ – Q.
ЧТОБЫ ПОДСЧИТАТЬ КОЛИЧЕСТВО ТЕПЛОТЫ (q), ВЫДЕЛЯЮЩЕЕСЯ ПРИ СГОРАНИИ ТОПЛИВА МАССОЙ (m), НЕОБХОДИМО УДЕЛЬНУЮ ТЕПЛОТУ СГОРАНИЯ (Q) УМНОЖИТЬ НА МАССУ СГОРЕВШЕГО ТОПЛИВА (m) :
q = m∙Q
7. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. СОСТОЯНИЕ ИДЕАЛЬНОГО ГАЗА, СВЯЗЫВАЮЩЕЕ ТРИ ПАРАМЕТРА – ДАВЛЕНИЕ (Р), ОБЪЕМ ( V) И ТЕМПЕРАТУРУ (Т), ХАРАКТЕРИЗУЮЩИЕ СОСТОЯНИЕ ДАННОЙ МАССЫ ДОСТАТОЧНО РАЗРЕЖЕННОГО ГАЗА.
ОДНА ИЗ ФОРМ ЗАПИСИ УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА НОСИТ НАЗВАНИЕ УРАВНЕНИЯ КЛАЙПЕРОНА:
![]() =const,
=const,
Где ![]() = R
= R
СОСТОЯНИЕ МОЛЯ ГАЗА ПРИ НОРМАЛЬНЫХ УСЛОВИЯХ ИМЕЕТ ДЛЯ ВСЕХ ИДЕАЛЬНЫХ ГАЗОВ ОДИНАКОВОЕ ЗНАЧЕНИЕ И НАЗЫВАЕТСЯ МОЛЯРНОЙ ГАЗОВОЙ ПОСТОЯННОЙ ИЛИ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ (R ).
ФИЗИЧЕСКИЙ СМЫСЛR : РАБОТА РАСШИРЕНИЯ ОДНОГО МОЛЯ ЛЮБОГО ГАЗА ПРИ НАГРЕВАНИИ НА 1 ГРАДУС.
![]() =Rили PV = RT
=Rили PV = RT
ЕСЛИ ЧИСЛО МОЛЕЙ РАВНО ʋ (n), ТО PV= ʋRT
ЧИСЛО МОЛЕЙ ʋ (n)
ʋ![]() , то
, то
PV= ʋRT= ![]() RT
RT
ЭТО УРАВНЕНИЕ СОСТОЯНИЯ ДЛЯ ПРОИЗВОЛЬНОЙ МАССЫ ИДЕАЛЬНОГО ГАЗА И НОСИТ НАЗВАНИЕ УРАВНЕНИЕ КЛАЙПЕРОНА-МЕНДЕЛЕЕВА.
ГАЗОВАЯ ПОСТОЯННАЯ R МОЖЕТ ПРИНИМАТЬ РАЗЛИЧНЫЕ ЗНАЧЕНИЯ В ЗАВИСИМОСТИ ОТ ЕДИНИЦ, В КОТОРЫХ ИЗМЕРЯЮТСЯ ДАВЛЕНИЕ И ОБЪЕМ.
а) В СИСТЕМЕ СИ РАЗМЕРНОСТЬ RРАВНА 8,31 Дж/К.моль
б) НАИБОЛЕЕ УПОТРЕБИТЕЛЬНЫЕ ЗНАЧЕНИЯ R :
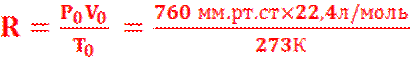
![]()
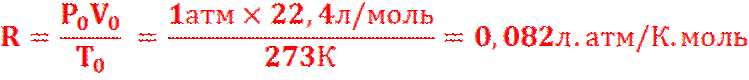
Или 8,31∙107 эрг/ К.моль, Т.К. 1 ЭРГ = 1∙10-7 Дж = 1,987 кал/ К.моль. 1 кал.≈4,19 Дж
8. ГАЗОВЫЕ ЗАКОНЫ. С ПОМОЩЬЮ УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА МОЖНО ИССЛЕДОВАТЬ ПРОЦЕССЫ, В КОТОРЫХ МАССА И ОДИН ИЗ ТРЁХ ПАРАМЕТРОВ (Р, V,T) ОСТАЮТСЯ НЕИЗМЕННЫМИ.
КОЛИЧЕСТВЕННЫЕ ЗАВИСИМОСТИ МЕЖДУ ДВУМЯ ПАРАМЕТРАМИ ПРИ ФИКСИРОВАННОМ ЗНАЧЕНИИ ТРЕТЬЕГО НАЗЫВАЮТ ГАЗОВЫМИ ЗАКОНАМИ.
а) ЗАКОН БОЙЛЯ-МАРИОТТА ПОКАЗЫВАЕТ ЗАВИСИМОСТЬ ДАВЛЕНИЯ ГАЗА ОТ ОБЪЕМА ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ (T=const):
![]() или P0 V0 = P1 V1
или P0 V0 = P1 V1
ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ ДАВЛЕНИЕ, ПРОИЗВОДИМОЕ ДАННОЙ МАССОЙ ГАЗА, ОБРАТНО ПРОПОРЦИОНАЛЬНО ОБЪЕМУ ГАЗА.
б) ЗАКОН ШАРЛЯ ПОКАЗЫВАЕТ ЗАВИСИМОСТЬ ДАВЛЕНИЯ
ДАННОГО ГАЗА ОТ ТЕМПЕРАТУРЫ ПРИ ПОСТОЯННОМ ОБЪЕМЕ (V=const):
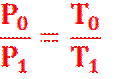
Или ![]()
ДАВЛЕНИЕ ДАННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОМ ОБЪЕМЕ ПРОПОРЦИОНАЛЬНО АБСОЛЮТНОЙ ТЕМПЕРАТУРЕ.
в) ЗАКОН ГЕЙ-ЛЮСАКА ПОКАЗЫВАЕТ ЗАВИСИМОСТЬ ОБЪЕМА ДАННОГО ГАЗА ОТ ТЕМПЕРАТУРЫ (Т= const):
![]() или
или
![]()
ОБЪЕМ ДАННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ ПРЯМО ПРОПОРЦИОНАЛЬНО АБСОЛЮТНОЙ ТЕМПЕРАТУРЕ.
9.ПРОПОРЦИЯ
a:b = c:d
aи d – крайние члены
bи c – средние члены
ПРАВИЛО :ПРОИЗВЕДЕНИЕ КРАЙНИХ ЧЛЕНОВ ПРОПОРЦИИ РАВНО ПРОИЗВЕДЕНИЮ СРЕДНИХ ЧЛЕНОВ
a∙ d = b ∙ c
МОЛЬ – ЭТО КОЛИЧЕСТВО ВЕЩЕСТВА, КОТОРОЕ СОДЕРЖИТ СТОЛЬКО ЖЕ ЧАСТИЦ ( МОЛЕКУЛ, АТОМОВ, ЭЛЕКТРОНОВ), СКОЛЬКО АТОМОВ УГЛЕРОДА СОДЕРЖИТСЯ В 12 г ИЗОТОПА 12С.
МАССА 1 АТОМА 12С РАВНА 12 а.е.м, ПОЭТОМУ ЧИСЛО АТОМОВ В 12 г ИЗОТОПА 12С РАВНО:
NA= 12г / 12г∙ 1,66057∙10-24 = 1/ 1,66057∙10-24 = 6,0221∙1023
ТАКИМ ОБРАЗОМ МОЛЬ ВЕЩЕСТВА СОДЕРЖИТ 6,0221∙1023 ЧАСТИЦ ЭТОГО ВЕЩЕСТВА.
NA – ПОСТОЯННАЯ АВОГАДРО, ИМЕЕТ РАЗМЕРНОСТЬ [NA]=МОЛЬ-1.
6,0221∙1023 – ЧИСЛО АВОГАДРО
МОЛЯРНАЯ МАССА – ОДНА ИЗ ОСНОВНЫХ ХАРАКТЕРИСТИК ВЕЩЕСТВА, ОПРЕДЕЛЯЕМАЯ ОТНОШЕНИЕМ МАССЫ ВЕЩЕСТВА К ЕГО КОЛИЧЕСТВУ, ВЫРАЖАЕТСЯ В КГ/МОЛЬ, КГ/КМОЛЬ, ИЛИ Г/МОЛЬ, ОБОЗНАЧАЕТСЯ М.
НАПРИМЕР, М (H2SO4) = 0,098 КГ /МОЛЬ= 98 Г/МОЛЬ
МОЛЕКУЛЯРНАЯ МАССА (ОТНОСИТЕЛЬНАЯ) Мr– РАВНА ОТНОШЕНИЮ МАССЫ МОЛЕКУЛЫ К 1/12 МАССЫ АТОМА 12С.
НАПРИМЕР, ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА Мr (H2SO4) РАВНА 98 Г
МОЛЯРНЫЙ ОБЪЕМ – ОБЪЕМ ВЕЩЕСТВА КОЛИЧЕСТВОМ 1 МОЛЬ, ОБОЗНАЧАЕТСЯ Vm;
НАПРИМЕР, Vm (Н2О)= 1,8∙10-5 М3/МОЛЬ или 0,018 Л/МОЛЬ.
ДЛЯ ГАЗОВ ПРИ НОРМАЛЬНЫХ УСЛОВИЯХ Vm= 22,4 Л /МОЛЬ.
МОЛЯРНАЯ КОНЦЕНТРАЦИЯ (ДЛЯ РАСТВОРА) - ОТНОШЕНИЕ КОЛИЧЕСТВА РАСТВОРЕННОГО ВЕЩЕСТВА К ЕДИНИЦЕ ОБЪЕМА РАСТВОРА. ОБОЗНАЧАЕТСЯ БУКВОЙ С.
НАПРИМЕР, С(KI)=0,5МОЛЬ/Л
МАССОВАЯ ДОЛЯ (W%)– ОТНОШЕНИЕ ЧАСТИ К ЦЕЛОМУ, ВЫРАЖАЕТСЯ В %
W%=![]() 100%
100%
ОБЪЕМНАЯ ДОЛЯ (φ %)- ОТНОШЕНИЕ ЧАСТИ ОБЪЕМА К ЦЕЛОМУ.
φ % =![]() 100%
100%
НАПРИМЕР, φ %(О2)-21% - ОБЪЕМНАЯ ДОЛЯ КИСЛОРОДА В ВОЗДУХЕ СОСТАВЛЯЕТ 21%
МОЛЬНАЯ ДОЛЯ (χ%-[ХИ]) – ОТНОШЕНИЕ КОЛИЧЕСТВА ДАННОГО ВЕЩЕСТВА К ОБЩЕМУ КОЛИЧЕСТВУ ВЕЩЕСТВ В ДАННОМ РАСТВОРЕ, СМЕСИ ИЛИ В ИНОЙ СИСТЕМЕ
НАПРИМЕР, χ%(Н2О)=5%- МОЛЬНАЯ ДОЛЯ ВОДЫ СОСТАВЛЯЕТ 5%.
ВЫХОД ПРОДУКТА РЕАКЦИИ (η%-[ЭТА]) – ОТНОШЕНИЕ МАССЫ, ОБЪЕМА
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.