Рибосому разделяет борозда, которая сильно расширяется в одном месте, обнажая « глаз» рибосомы. Эта особенность отражает реальный факт существования полости между рибосомными субчастицами. Именно в этой полости размещаются основные субстраты рибосомы—молекулы пептидил-тРНК и аминоацил-тРНК, участвующие в образовании полипептидной цепи. Это –тРНК—связывающий центр рибосомы. Малая субъединица рибосомы имеет « головку» и « тело»., образуемые глубокой бороздой. Последняя выполняет функцию « шеи « -- место, в котором размещается участок связывания мРНК и через которое цепь протягивается от одного конца к другому. У большой рибосомной субцастицы в « шее « размещается главный каталитический центр рибосомы—пептидил-трансферазный центр.
Обе « шеи» находятся напротив друг друга и между ними располагается «глаз». Важной характерной чертой рибосомы является подвижный палочкообразнвй выступ большой субъединицы, справа от «головки». Генетические функции малой рибосомной субчастицы: Именно малая субъединица рибосомы, и только она, связывается с мРНК, т.е. служит первичным приемником генетической информации для белок-синтезирующего аппарата. Удержание мРНК на рибосоме есть функция малой субчастицы, в то время как большая в этом не участвует.
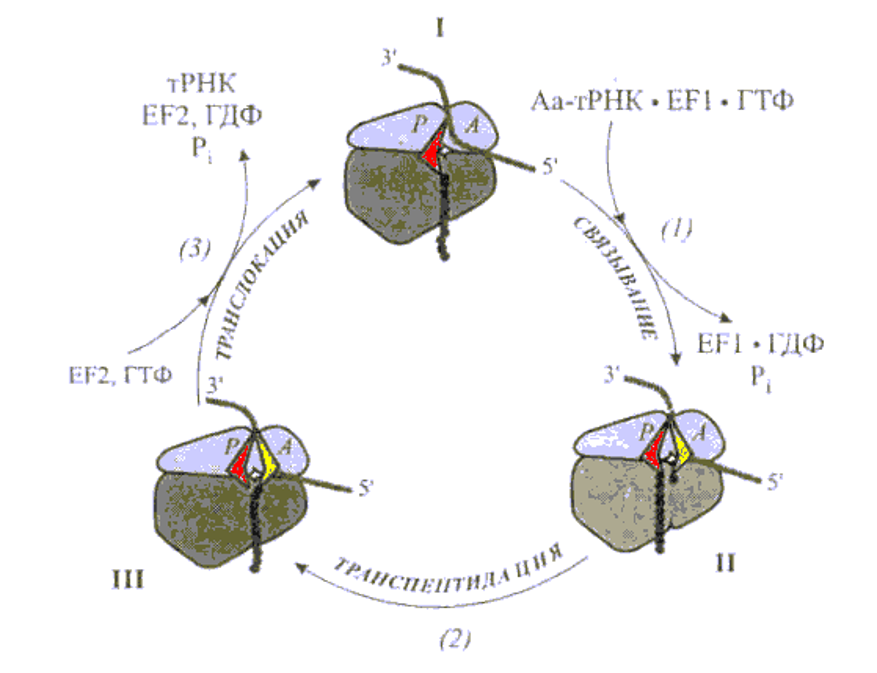
Центр Р рибосомы занимает пептидил-тРНК, и рибосома может связывать молекулу аминоацил-тРНК, соответствующую кодону, установленному в данный момент в А-участке.. ( шаг I ). В результате удерживаемая рибосомой пептидил-тРНК и вновь связанная аминоацил-тРНК, оказываются в рибосоме в состоянии – бок—о -- бок ( состояние II ). Рибосома катализирует р-цию транспептидации между двумя субстратами рибосомы—пептидил-тРНК и аминоацил –тРНК: пептидильный остаток переносится от « своей» тРНК на аминогруппу аминоацил-тРНК, удлиняясь на одну аминокислоту с С-конца. ( шаг II). В Р-участке осталась деацилированная тРНК, а в А- участке помещается остаток тРНК, удлиненной пептидил-тРНК ( состояние III ). Деацилированная тРНК выталкивается из Р-участка, а пептидил-тРНК перемещается, вместе со связанным с ней кодоном мРНК, из А- участка в Р- участок ( шаг III).
В итоге А-участок освобождается, и в нем устанавливается следующий кодон мРНК. Цикл завершен. Факторы элонгации FЕ-1 и ЕF-2. Таким образом, большая субъединица рибосомы выступает как фермент, ответственный за образование пептидных связей. Это главная энзиматическая функция рибосомы. В рибосоме есть четкое разделение труда: малая субъчастица выполняет генетические функции, являясь ответственной за прием и декодирование генетической информации. Большая частица участвует в энзиматических реакциях в процессе трансляции.
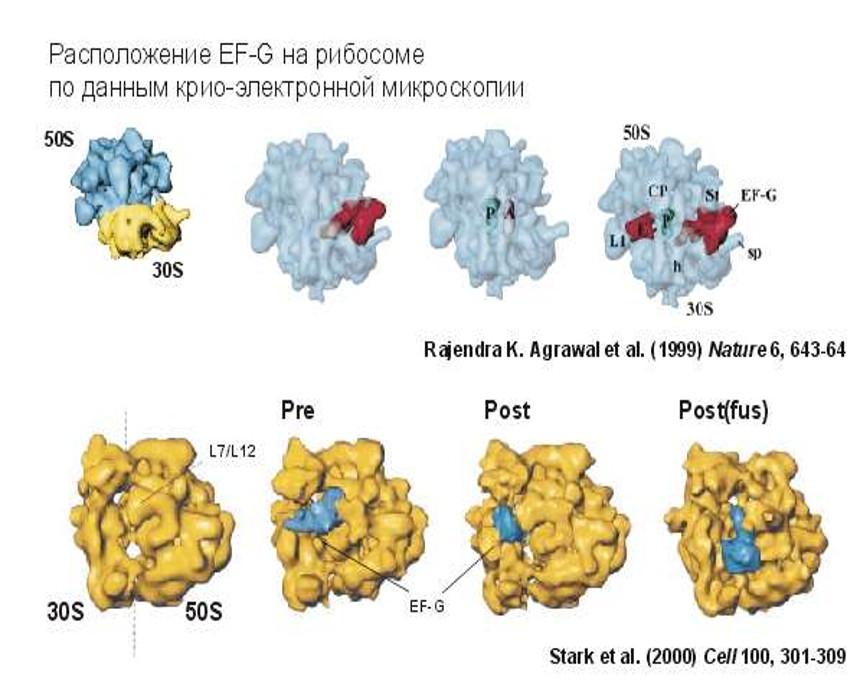
К О Н Ф О Р М А Ц И О Н Н А Я П О Д В И Ж Н О С Т Ь Р И Б О С О М
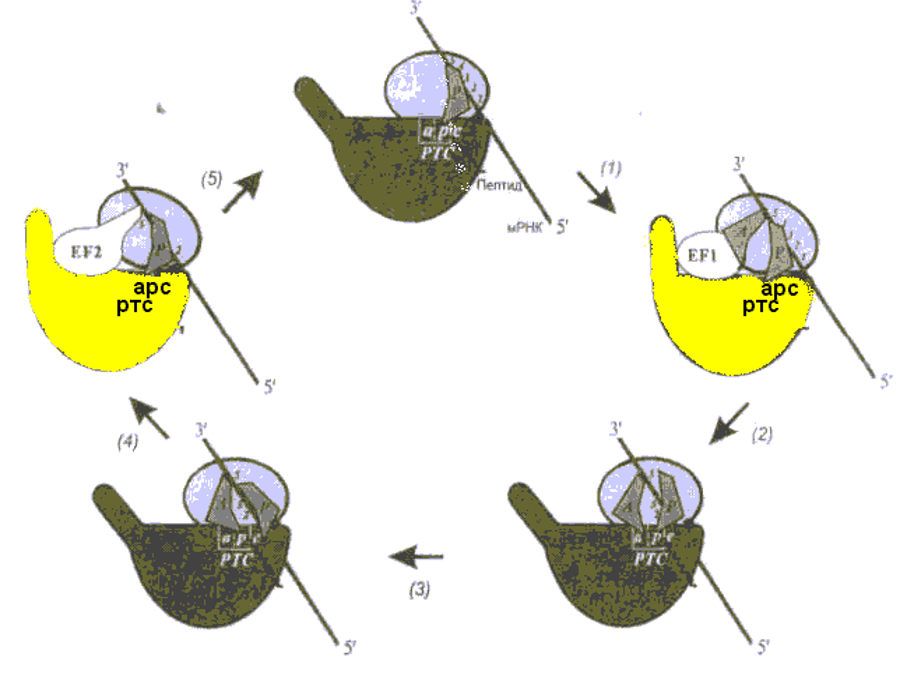
Цикл Элонгации в рибосоме рассматривается с точки зрения модели смыкания- размыкания (1), а фактор элонгации ЕF- 1 с ГТФ открывает рибосому. (2) После расщепления ГТФ, фактор элонгации ЕF-1 покидает рибосому, а аминоацильный конец-тРНК взаимодействует с пептидил- трансферазным центром большой субчастицы, и способствует смыканию субчастиц и запиранию рибосомы. (3)
Реакция транспептидации происходит в « закрытой « рибосоме между группами двух субстратов- пептидил—тРНК и аминоацил—тРНК. (4).Размыкание пре-транслокационной рибосомы промотируется фактором элонгации ЕF-2 с ГТФ. Это приводит к выходу деацилированной тРНК и смещению остатка тРНК молекулы пептидил-тРНК вместе с мРНК. (5) Гидролиз ГТФ и уход фактора элонгации ЕF-2 снова дает возможность рибосоме сомкнуться. В ходе элонгационного цикла рибосома осциллирует между сомкнутым и разомкнутым состояниями.
Антибиотики- вещества, синтезируемые микроорганизмами и подавляющие размножение бактерий, других микробов, а также вирусов и клеток. Большинство антибиотиков продуцируются микроорганизмами из рода актиномицетов ( Streptomyces sp. ) и определенными грибами. Однако существуют и синтетические антимикробные вещества, такие как сульфаниламиды и ингибиторы гираз.
Интеркаляторы такие как рифамицин, рубомицин и актиномицин D встраиваются в двойную спираль ДНК, таким образом препятствуя репликации и транскрипции. Интеркаляторы токсичны и для эукариот, поэтому их применение в качестве цитостатиков ограниченно. Синтетические ингибиторы ДНК-топоизомераз, так называемые –Ингибиторы гираз воздействуют на репликацию, и тем самым подавляет репродукцию бактерий. К ингибиторам трансляции относится большая группа антибиотиков, воздействующих на рибосому ( Аминогликозиды, Тетрациклины, Эритромицин, Пуромицин, Хлорамфеникол). Тетрациклины- антибиотики широкого спектра действия. Аминогликозиды, воздействуют на все фазы трансляции.
Эритромицин нарушает нормальную функцию большой рибосомной субцастицы. Хлорамфеникол-является одним из немногих природных нитросоединений, ингибирующих пептидилтрансферазу.Пуромицин имитирует аминоацил-тРНК, вызывая преждевременную терминацию элонгации. Бета- лактамные антибиотики (наиболее известные пенициллины и цефалоспорины) ингибируют синтез клеточных стенок бактерий.
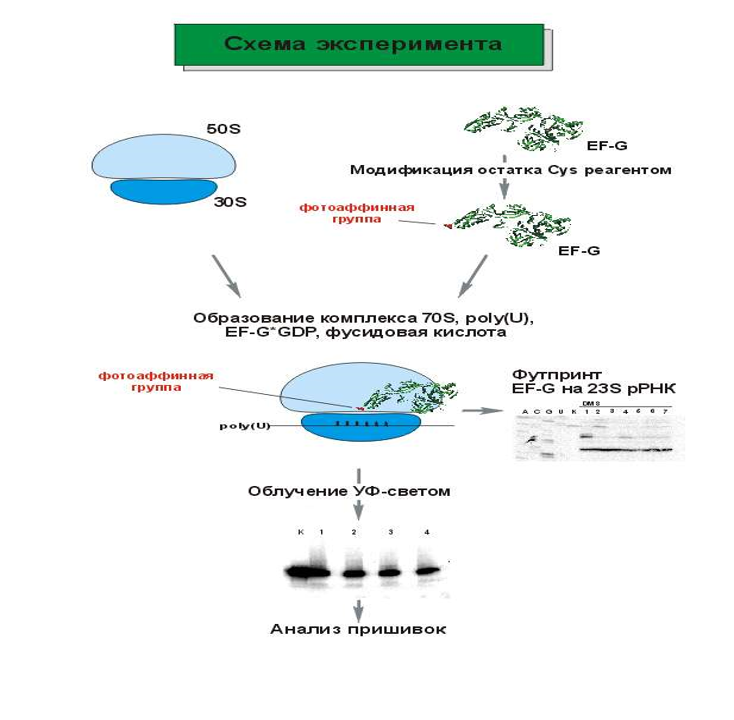
Cхема
Эксперимента
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.