





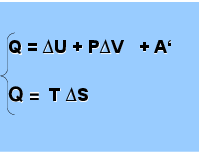








































Лекция 3
СВОБОДНАЯ ЭНЕРГИЯ ГИББСА
План
3.1 Свободная энергия Гиббса 3.2 Способы расчета G 3.3 Основы биоэнерге-тики
Обе тенденции в протекании изобарных процессов находят свое отражение в термо-динамической функции сос-тояния, называемой свободной энергией Гиббса или изобарно-изотермическим потенциалом G:
G = H - TS

Американский физик и химик, один из основоположников клас-сической термодинами-ки, профессор физики и химии в Йельском университете. Он пер-вым применил термо-динамические законы для описания биоло-гических систем.
Дж.У.Гиббс (11.II.1839 - 28.IV.1903)
Физический смысл Свободной энергии Гиббса понятен из совместного рассмот-рения первого и второго законов термодинамики.
Q = ∆U + P∆V + A‘ Q = T ∆S
Отсюда
A’ = TS - U - pV = = TS - (U + pV ), где U + pV = H
Следовательно, A’ = - (H - TS), где H - TS = G
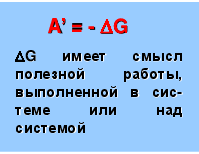
A’ = - G G имеет смысл полезной работы, выполненной в сис-теме или над системой
G – это часть внутренней энер-гии системы, спо-собная превра-щаться в полез-ную работу
Знак ΔG (+ или –) является критерием возможности протека-ния самопроизволь-ных процессов в закрытых системах.
Самопроизвольный процесс: A′ > 0 ∆G < 0 Термодинамическое равновесие A′ = 0 ∆G = 0 Несамопроизвольный процесс: A′ < 0 ∆G > 0
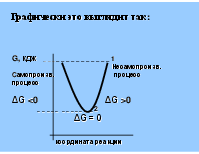
Графически это выглядит так:
G, кдж _ _ _ _ _ _ _ _ _ _ _ _ _ _ 1 Несамопроизв. Cамопроизв. процесс процесс ΔG <0 ΔG >0 _ _ _ _ _ _ _ _ _ _ _ _ 2 ΔG = 0 координата реакции
Таким образом, само-произвольно осуществ-ляются те процессы, протекание которых сопровождается уменьше-нием свободной энергии Гиббса.
Характер процесса иногда можно изменять, варьируя термодинамические па-раметры системы: тем-пературу, давление или концентрацию реагиру-ющих веществ.
Влияние температуры на характер процесса
А)
ΔG = ΔН – ТS (–) (+) Экзотермический Увеличение процесс беспорядка В этом случае ΔG < 0, следовательно, самопроизвольный процесс протекает при любой температуре;
Влияние температуры на характер процесса
ΔG = ΔН – ТΔS (–) (–) Экзотермический Уменьшение процесс беспорядка 0<ΔG < 0 G<0 при низкой Т, следовательно самопроизвольный процесс проте-кает при низкой температуре;
Б)
Влияние температуры на характер процесса
ΔG = ΔН – ТΔS (+) (+) Эндотермический Увеличение процесс беспорядка 0<ΔG < 0 G <0 при высокой Т, следова-тельно самопроизвольный процесс протекает при высокой температуре;
В)
Влияние температуры на характер процесса
Г)
ΔG = ΔН – ТΔS (+) (–) Эндотермический Уменьшение процесс беспорядка ΔG > 0 при всех температурах, следовательно процесс является несамопроизвольным; он термо-динамически запрещен.
Способы расчета G
1.
По уравнению: ΔrG = ΔrH – ТΔrS, где ТΔrS – энтропийный фактор химической реакции
Способы расчета G
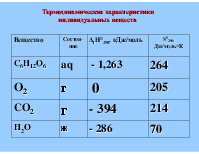
Пример: Рассчитать ΔrG0298 биохимической реакции: С6Н12О6 (aq) + 6 О2 (г) → 6 СО2(г) + 6 Н2О (ж)
Термодинамические характеристики индивидуальных веществ

2) Расчет энтропии реакции ΔrS по закону Гесса: ΔrS = 6 ×S(CO2) + 6 ×S(H2O) – S(гл.) – 6 ×S(O2) = 6,214 + 6,70 – 264 – 6,205 = 210 Дж/ K = 0,21 кДж/ K – реакция протекает с увеличением беспорядка TΔrS = 298 × 0,21 = 62,58 кДж
3) Расчет свободной энергии Гиббса ΔrG = ΔrH – TΔrS = –2817 – 298 × 0,21 = – 2879,6 кДж Вывод: при стандартных условиях реакция протекает самопроизвольно
Способы расчета G
2) На основе закона Гесса, используя стандартные свободные энергии образования реагентов и продуктов(∆fG, kДж/мол): ΔгG = с ΔfG (C) + d ΔfG (D) - a ΔfG (A) - b ΔfG (B)
Способы расчета G
3)Расчет свободной энергии реакций, протекающей в растворах в условиях отличных от стандартных, выполняется по уравнению изотермы химической реакции: [C]c [D]d ΔrG = ΔrG0 + RT ln ------------- [A]a [B]b где [A] и [B] – концентрации исходных веществ, моль/л [C] и [D] – концентрации продуктов, моль/л.
Способы расчета G
Для газофазных реакций уравнение изотермы имеет следующий вид: рc × рd ΔrG = ΔrG0 + RT ln ------------- рa × рb где р – парциальное давление газа в газовой смеси
Способы расчета G
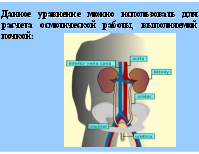
4) Расчет G процесса по переносу вещества из одной фазы в другую
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.