36(1).Электроды 1 и 2 рода,
окислительно-восстановительный, сравнения.
Электроды первого рода. В потенциалопределяющих реакциях на этих
электродах участвует один вид ионов. Металлические электроды, обратимые
относительно катионов (в том числе и амальгамные), и металлоидные, обратимые
относительно анионов:
![]() Уравнение потенциалопределяющей реакции на электродах, обратимых относительно
катионов,
Уравнение потенциалопределяющей реакции на электродах, обратимых относительно
катионов, ![]() Электродный потенциал с учетом того, что активность твердого вещества при
данной температуре постоянна и равна единице:
Электродный потенциал с учетом того, что активность твердого вещества при
данной температуре постоянна и равна единице: ![]() А м а л ь г а м н ы е электроды состоят из амальгамы металла, находящейся в
контакте с раствором, содержащим ионы этого металла :
А м а л ь г а м н ы е электроды состоят из амальгамы металла, находящейся в
контакте с раствором, содержащим ионы этого металла : ![]() Уравнения
потенциалопределяющей реакции электрода и его потенциала:
Уравнения
потенциалопределяющей реакции электрода и его потенциала: ![]()
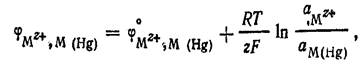 К электродам первого рода относятся также газовые.
К электродам первого рода относятся также газовые.
Водородный электрод
пластинка из платины, покрытая электролитической платиновой чернью, погруженной
в раствор, содержащий потенциалопределяющие вещества, через который
пропускается водород. В кислой среде системе ![]() отвечает уравнение потенциалопределяющей
реакции
отвечает уравнение потенциалопределяющей
реакции ![]() которое
может быть записано в упрощенном виде:
которое
может быть записано в упрощенном виде: ![]()
Потенциал водородного электрода 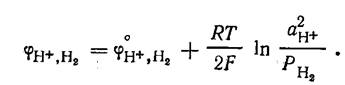
Поскольку стандартный потенциал
водородного электрода при всех температурах условно принят равным нулю, то при Р,
= 1 потенциал электрода определяется рН раствора: ![]() В щелочной среде в системе
В щелочной среде в системе ![]() протекает потенциалопределяющая реакция по
уравнению
протекает потенциалопределяющая реакция по
уравнению ![]() которому отвечает уравнение для расчета потенциала:
которому отвечает уравнение для расчета потенциала: ![]() Водородный электрод применяется как индикаторный при экспериментальном
определении рН растворов.
Кислородный электрод по устройству аналогичен водородному электроду. В
щелочной среде для системы
Водородный электрод применяется как индикаторный при экспериментальном
определении рН растворов.
Кислородный электрод по устройству аналогичен водородному электроду. В
щелочной среде для системы ![]() электродный процесс и отвечающее ему
уравнение для расчета потенциала
электродный процесс и отвечающее ему
уравнение для расчета потенциала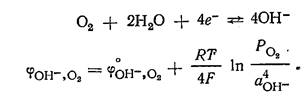
Создать практически кислородный
электрод с данной реакцией не удается, так как в реальных условиях металлы под
действием кислорода окисляютсяэПотенциал Кислородного электрода как в щелочной,
так и кислой среде зависит от рН раствора: 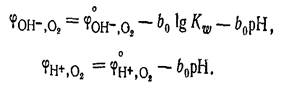
Электроды второго рода.
![]() Такие электроды состоят из трех фаз:
металл покрыт слоем его труднорастворимой соли и погружен в раствор, содержащий
анионы, одноименные с анионами соли:
Такие электроды состоят из трех фаз:
металл покрыт слоем его труднорастворимой соли и погружен в раствор, содержащий
анионы, одноименные с анионами соли:
В потенциалопределяющей реакции
на этом электроде принимают участие как катионы, так и анионы.
Электрохимическому процессу ![]() сопутствует химическая реакция, приводящая к
осаждению или растворению МА:
сопутствует химическая реакция, приводящая к
осаждению или растворению МА: ![]() Суммарное уравнение реакции, согласно
которой электрод обратим относительно аниона,
Суммарное уравнение реакции, согласно
которой электрод обратим относительно аниона,
![]() Последней реакции соответствует уравнение для расчета электродного потенциала
Последней реакции соответствует уравнение для расчета электродного потенциала 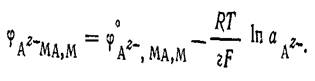
Электрод второго рода можно
рассматривать как электрод первого рода, обратимый относительно катиона у
которого активтность в растворе определяется растворимостью МА. Вследствие
устойчивости потенциалов электроды второго рода могут быть использованы как
электроды сравнения при потенциометрических измерениях. для этого наиболее
употребительны каломельный и хлорсеребряный электроды.
Каломельный электрод состоит из ртути, покрытой пастой, содержащей
каломель, и соприкасающейся с раствором хлорида калия: ![]() .
.
Уравнение потенциалопределяющей реакции ![]() По концентрации применяемого раствора КСI различают 0,1 н., 1 н. и насыщенный
каломельные электроды. Последний имеет наиболее широкое применение.
По концентрации применяемого раствора КСI различают 0,1 н., 1 н. и насыщенный
каломельные электроды. Последний имеет наиболее широкое применение.
Хлорсеребряный электрод серебряная пластинка, покрытая АgС1 и погруженная в раствор КСI. Уравнение электродной реакции
![]() Окислительно-восстановительные электроды. Все электроды, которым
соответствует потенциалопределяющие реакции с участием электронов, представляют
собой окислительно-восстановительные системы. Однако принято в особую группу
выделять электроды, в потенциалопределяющих реакциях которых не участвуют
простые вещества — газы,
металлы. Эти электроды называются окислительновосстановительяыми (редокси-электроды).
В общем виде схема электрода и уравнение потенциалопределяющей реакции
записываются так:
Окислительно-восстановительные электроды. Все электроды, которым
соответствует потенциалопределяющие реакции с участием электронов, представляют
собой окислительно-восстановительные системы. Однако принято в особую группу
выделять электроды, в потенциалопределяющих реакциях которых не участвуют
простые вещества — газы,
металлы. Эти электроды называются окислительновосстановительяыми (редокси-электроды).
В общем виде схема электрода и уравнение потенциалопределяющей реакции
записываются так:
![]() Сюда относятся в первую очередь электроды, у которых Ох и Red
представляют собой ионы, причем электродная реакция состоит в перемене их
заряда. Потенциал окислительно-восстановительного электрода для систем,
характеризующихся равновесием
Сюда относятся в первую очередь электроды, у которых Ох и Red
представляют собой ионы, причем электродная реакция состоит в перемене их
заряда. Потенциал окислительно-восстановительного электрода для систем,
характеризующихся равновесием![]() , потенциал рассчитывается по уравнению
, потенциал рассчитывается по уравнению ![]() Кроме относительно
простых окислительно-восстановительных электродов существуют более сложные, в
потенциал- определяющих реакциях которых участвуют ионы Н+ и молекулы воды.
Например, системе
Кроме относительно
простых окислительно-восстановительных электродов существуют более сложные, в
потенциал- определяющих реакциях которых участвуют ионы Н+ и молекулы воды.
Например, системе ![]() отвечают
уравнения электродной реакции и для расчета потенциала электрода:
отвечают
уравнения электродной реакции и для расчета потенциала электрода: 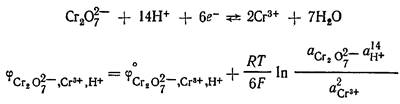
Из расчетного уравнения видно, что потенциал редокс электрода зависит
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.