Равновесный процесс - это процесс, состоящий из непрерывного ряда равновесных состояний. Равновесное состояние - состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты.
Химическое равновесие характеризуется неизменностью числа молекул веществ, составляющих химическую систему, при неизменных внешних условиях, а также:
- самопроизвольное восстановление состояния равновесия после снятия внешнего воздействия, вызвавшего отклонение системы от положения равновесия.
- скорость прямого процесса = скорости обратимого процесса.
-
при ![]() и при
и при ![]()
Рассмотрим некоторые факторы, влияющие на равновесие.
1) Принцип Ле-Шателье:” Если воздействовать на систему, находящуюся в химическом равновесии, то состояние системы изменится таким образом, что оказанное воздействие ослабляется”.
-
температура. В эндотермических реакциях ![]() равновесие сместится в
сторону образования продуктов реакции, а в экзотермических реакциях
равновесие сместится в
сторону образования продуктов реакции, а в экзотермических реакциях ![]() равновесие сместится в
сторону исходных веществ.
равновесие сместится в
сторону исходных веществ.
- давление. При уменьшении объема реакционной системы → повышается давление→ в сторону продуктов, при увеличении объема реакционной системы → уменьшается давление→ в сторону исходных веществ.
- концентрация. При избытке исходных реагентов равновесие смещается в сторону образования продуктов реакции, а при недостатке - в сторону исходных реагентов.
2)
Уравнение Вант-Гоффа: ![]() .
.
3)
Уравнение изотермы: ![]() .
.
16. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ И ФАКТОРЫ, ВЛИЯЮЩИЕ НА НЕЕ.
Скорость химической реакции - количество прореагировавшего исходного реагента А в 1-цу времени в 1-це объема системы:
![]()
При ![]() :
: ![]()
При ![]() :
: ![]()
Знак “-“ - исходный реагент, а знак “+“ - продукт реакции.
Рассмотрим несколько факторов, влияющих на скорость химической реакции.
1) Концентрация. Скорость химической реакции пропорциональна концентрации реагентов:
![]() , где
, где
k - константа скорости реакции.
2) Механизм реакции. Если реакция проходит в несколько стадий, то определяющей скоростью будет скорость самой медленной стадии.
3) Температура.
По правилу Вант -Гоффа: “ При изменении температуры на 10![]() , скорость меняется в 2-4
раза”.
, скорость меняется в 2-4
раза”.
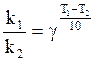
По
уравнению Аррениуса: ![]() .
.
4) Катализатор. Обычно катализаторы увеличивают скорость химической реакции, но он обладает селективностью.
17.Методы анализа экспериментальных данных
Константы хим.уравнений находятся только экспериментальным путем.
1.Зависимость Скорости от концентрации при Т=соnst
2.Зависимость Константы скорости от Т
Реакторы для получения экспериментальных данных:
1) периодического действия (изучение гомогенных процессов)
2) проточные (для гетерогенных процессов)
2 метода анализа эксп. Данных: Интегральный и Дифференцияльный
Интегральный (суммарный , в целом)
Проверка заданного кинетического ур. Интегрированием и последущим сравнением предсказанной и экспериментальной зависимости концентрации от температуры Т.
Методика:
а) Деоается предположение о механизмеи находится соответствующее выражение скорости. Для исходного вещ-ва А при V=const:
-wA=-dCA/dt=f(k*c)=k*f(c) – кинетическое Ур-ие б) f(c) зависит только от концентрации компонентов, котрые можно выразить через величину CA : -dC A /f(CA)=k*dt
dC A /f(CA)= F (CA)=k dt=k*t
в) По экспериментальным значениям концентрации компонентов определяется числовое значение F (CA) для разных моментов времени.
г) Строятся графики F (CA) от t :
“+” Если график Прямая линия (из нуля) то принятое Ур-ие согласуется с экспериментальными данными.
“-“Если экспериментальные точки не ложатся на прямую То Ур-ие выбрали не верно Выбирают другое.
Этот метод удобен для анализа простых кинетических Ур-ий , описывающих экспериментальные реакции.
Дифференциальный
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.