Билет63.Кин-ка гетероген.кат.р-ций,к-рые не тормозятся продуктами р-ции.Будем рассмат-ть р-ции на тв.К,в к-рых реагир.в-ва и продукты р-ции газообраз.В типич.гетероген.пр-се регир-ют т-ко те в-ва,к-рые адсорбир-ны на пов-ти.Скор.гет.х.р. опр-ся как кол-во в-ва,реагир в ед. вр. на ед. площади пов-ти К:υ=dx/Sdt,x-кол-во в-ва,прореагир. к моменту вр t,моль;S-общ.площадь пов-ти К,на к-рой идёт х.р.Скор. гет.х.р. прямо пропорц-на пов-ной конц в-в,к-рая прямо пропорц-на степени заполнения пов-ти θ→ dx/Sdt=θ.Т.к. пов-ть дан.К постоянна, то величину общ.пов-ти К можно ввести в константу скор.k’, т.е. k’S=k → dx/dt=kθ(1).Величину пов-ти,занятую реагир.в-вом на 1 см2 пов-ти К,можно найти,исходя из ур-я:θ=Kp/(1+Kp)(2),p-дав-е газа,К-константа рав-сия адсорб-ции(адсорб.коэф-т).Из(2) след.,что если адс-ция мала,то θ<<1,и К<<1,поэтому Кр в знаменателе пренебрегаем.Тогда из (2): θ=Кр(3),т.е. при малых дав-ях пов-ть,занятая адсорбир. в-вом,прямо пропорц-на дав-ю.Эта обл. наз-ся обл-тью линейной адс-ции.Если адс-ция велика,то Кр>>1,и в знаменателе (2) пренеб-ем 1→θ=1(4)-ур-е асимптоты кривой,опис-мой ур-ем (2).Если реаг-ет одно в-во и его адс-ция мала,то,подставив в (1) знач-е θ из(2):dx/dt=kKp(5).Пусть kK=k*→выр-е (5) примет вид:dx/dt=k*p(6). p=ni/V *RT=(n0-x)/V *RT(7),ni= n0-x-число грамм-мол-л исх.в-ва в момент вр. t,n0-в начальн.момент,V-общ объём системы.Подставим (6) в (5) и получим ур-е,удобное для интегрирования(k*-кажущаяся константа скор.пр-са).Подставим (2) в (1): dx/dt=k*∙(p/1+Kp).Это выр-ние соответ-ет случаям,когда реагир.в-во адсорб-ся умеренно:dx/dt=k*p1/n.Такой дробный порядок явл-ся кажущимся.Он получ-ся,т.к. в кин-кое ур-е вводим величины,хар-щие изменение конц.в-ва не непосред-но на пов-ти,а в объёме.В наше выр-е входит не пов-ная конц,хар-мая велич.θ,а величина,хар-щая сод-е реагир.в-ва в объёме-его парциальное дав-е р.Если реагир. в-во сильно адс-ся,то θ=1,тогда подставив (4) в (1):dx/dt=k(кажущ-ся порядок равен 0,р0=1).
Билет64.Связь
м\у истинной и кажущ-ся энериями активации.Если построить на основании экспер-ных данных график завис-ти кажущ-ся
константы скорости k* от 1/T,то получ-ся прямая,опис-мая ур-ем:lnk*=-E*/RT+lnc или dlnk*/dt=E*/RT2(1),где E*-кажущ-ся Еа.Найдём завис-ть м\у Еа
и E*. k*=kK.Адсорбцион.коэф-т(константа рав-сия) К равен отнош.
констант скоростей пр-сов адс-ции и десорб-ции:К=k1/k2, k*=k∙ k1/k2(2).Каждая
из констант,входящих в (2),явл-ся функцией тем-ры.Т.к. k1=C’/√T(C’-величина постоянная), k2=C”e-λ/RT(3)(C”-велич.постоян.,λ-т-та
адсорбции),k=Ce-E/RT(4).Константа
скорости пр-са адс-ции k1 с
тем-рой измен-ся очень мало по срав-ю с k и k2.Завис-тью k1 от тем-ры можно пренебречь и считать,что эта величина
постоянная.Подставив (3) и (4) в (2):k*=Ce-E/RT∙k1/(C’e-λ/RT)→lnk*=-E/RT+λ/RT+lnconst (const=Ck1/C’). Дифференц-ем по Т:dlnk*/dT=(E-λ)/RT2(5)/Сравнивая (5) и (1),видим: Е*=Е-λ(6).Это выр-е
хар-ет завис-ть кажущ-ся Еа от истин. Е* меньше Еа на
величину т-ты адс-ции реагир.в-ва.Для простешей р-ции А→В на пов-ти тв.К можно
выделить 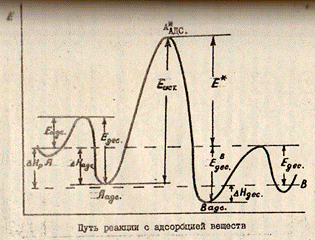 стадии:А→Аадс→А*адс
→Вадс→В. Вначале м-лы в-ва А адс-ся на пов-ти тв.К,преодолевая
энерг.барьер Еадс.Выделяя избыток энергии в форме т-ты адс-ции,м-ла
может перейти в более уст-вое адсор-ное сост.Аадс.На новом кат-ком
центре или под воздействием актив.центра К м-ла А может перейти в
электронно-возбуждённое сост с переходом на энергетический барьер высотою Еист.(А*адс).Возбуждённые
м-лы А,скатываясь в ложбину продукта р-ции,превращ-сяв прод.р-ции.При этом м-ла
В переходит в адсорбир.сост.Для десорбции м-лы В с актив.ц. ей необх-мо
преодолеть энергию ЕВадс.После чего м-ла В может уйти с
каталит.центра в объём реакцион.смеси.
стадии:А→Аадс→А*адс
→Вадс→В. Вначале м-лы в-ва А адс-ся на пов-ти тв.К,преодолевая
энерг.барьер Еадс.Выделяя избыток энергии в форме т-ты адс-ции,м-ла
может перейти в более уст-вое адсор-ное сост.Аадс.На новом кат-ком
центре или под воздействием актив.центра К м-ла А может перейти в
электронно-возбуждённое сост с переходом на энергетический барьер высотою Еист.(А*адс).Возбуждённые
м-лы А,скатываясь в ложбину продукта р-ции,превращ-сяв прод.р-ции.При этом м-ла
В переходит в адсорбир.сост.Для десорбции м-лы В с актив.ц. ей необх-мо
преодолеть энергию ЕВадс.После чего м-ла В может уйти с
каталит.центра в объём реакцион.смеси.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.