Электрофоретическое торможение.При наложении на раствор электрического поля центральный ион и его ионная атмосфера, обладающие противоположными по знаку зарядами, движутся в противоположных направлениях. Поскольку ионы гидратированы, то движение ионов движение центрального иона происходит в среде, перемещающейся ему навстречу. Поэтому движущийся ион находится под влиянием дополнительной тормозящей силы, что приводит к снижению его скорости.
Релаксационное торможение. Ионная атмосфера обладает центральной симметрией. При движении иона в электрическом поле симметрия нарушается, что связано с разрушением атмосферы в одном положении иона и формированием ее в другом, новом. Этот процесс происходит с конечной скоростью с течением некоторого времени – временем релаксации. Вследствие этого ионная атмосфера теряет центральную симметрию, и позади движущегося иона всегда будет некоторый избыток заряда противоположного знака. Возникающие при это силы электрического притяжения будут тормозить движение иона.
Силы релаксационного и электрофоретич. торможения
¨ определяются ионной силой раствора, природой растворителя и температурой.
¨ ↑ с ↑ концентрации р-ра при постоянстве прочих условий
27. В чем состоит эффект Вина? Что такое дисперсия электропроводности?
Эффект Вина
В постоянных электрических полях достаточно высокой напряженности (104-105 В/см)
Ионы движутся настолько быстро, что ионная атмосфера не успевает образовываться, вследствие чего практически отсутствуют эффекты торможения, а λ стремится к λ∞.
В слабых электролитах эффект Вина вызывается также смещением диссоциативного равновесия в сильном электрическом поле в сторону образования ионов.
Дисперсия электропроводности (частотный эффект). При увеличении частоты переменного тока выше некоторого значения наблюдается увеличение электропроводности, т.к. при достаточно высокой частоте взаимные смещения иона и ионной атмосферы настолько малы, что ионная атмосфера практически симметрична.
Частота переменного тока, при которой можно ожидать возрастания электропроводности, - это величина, обратная времени релаксации
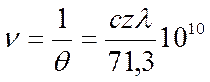
Следовательно должен исчезнуть эффект релаксационного торможения.
(Эффект Вина возникает при полном уничтожении ионной атмосферы, а следовательно и обоих эффектов торможения. Частотный эффект объясняется лишь исчезновеним ионной атмосферы. Опыт показывает, что последний эффект прим. в 3 раза слабее, чем эффект Вина, т.е. электрофоретический эффект в 2 раза сильнее эффекта релаксации)
28. Активности и коэффициенты активностей электролитов. Методы их определения и вычисления.
Активность связана с химическим потенциалом компонента раствора
уравнением: ![]()
Индекс х указывает, что активность относится к раствору, в котором концентрация вещества выражена в молярных долях. Активность также иногда называют эффективной или действующей концентрацией.
Коэффициент активности – мера отклонения свойств раствора от св-в идеального раствора той же концентрации.
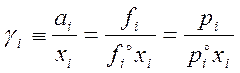 ,
где γ – мольный коэф. активности,
,
где γ – мольный коэф. активности,
Возможны сопоставления активностей компонентов с концентрациями, выраженными в других единицах:
¨ мольно-объемные концентрации (с)
![]() ,
где f – мольный коэффициент активности
,
где f – мольный коэффициент активности
¨ моляльность (m)
![]() где γ’ – практический коэффициент активности
где γ’ – практический коэффициент активности
В общем случае свойства различных ионов в растворе неодинаковы и можно ввести и рассмотреть термодинамические функции для ионов различного типа:
1. Рассмотрим 2-х компонентный раствор, состоящий из растворителя и соли, диссоциирующей по уравнению:
![]()
2.
Хим. потенциал: ![]() -
-
(2 уравнения К+ и А-)
3. Сделаем предположения:
- взято 1000г растворителя, n1=1000/M1, n2=m – моляльность
-
электролит диссоц. нацело: ![]()
- T,P = const, Þ по ур-ю Гиббса-Дюгема (изм-е хим. потенц-ов комп-ов р-ра при изм-ии состава р-ра):
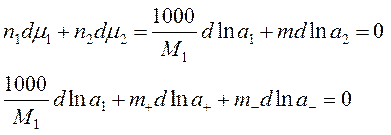 - вычтем из 1-го 2-ое:
- вычтем из 1-го 2-ое: 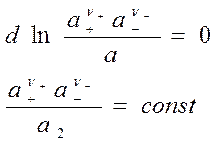
-
введем среднюю ионную активность ![]() , где
, где ![]() ;
;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.