



Домашняя работа №1. Вариант 13
Дана зависимость составов жидкой фазы и находящейся с ней в равновесии пара от температуры для двухкомпонентной жидкой системы А – В при постоянном давлении. Молярный состав жидкой фазы x и насыщенного пара y выражен в процентах вещества А. По приведенным данным :
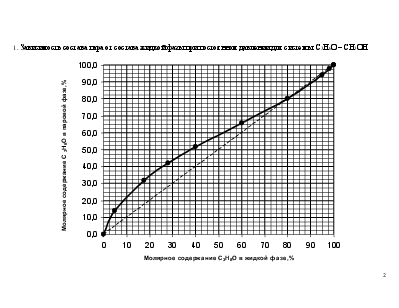
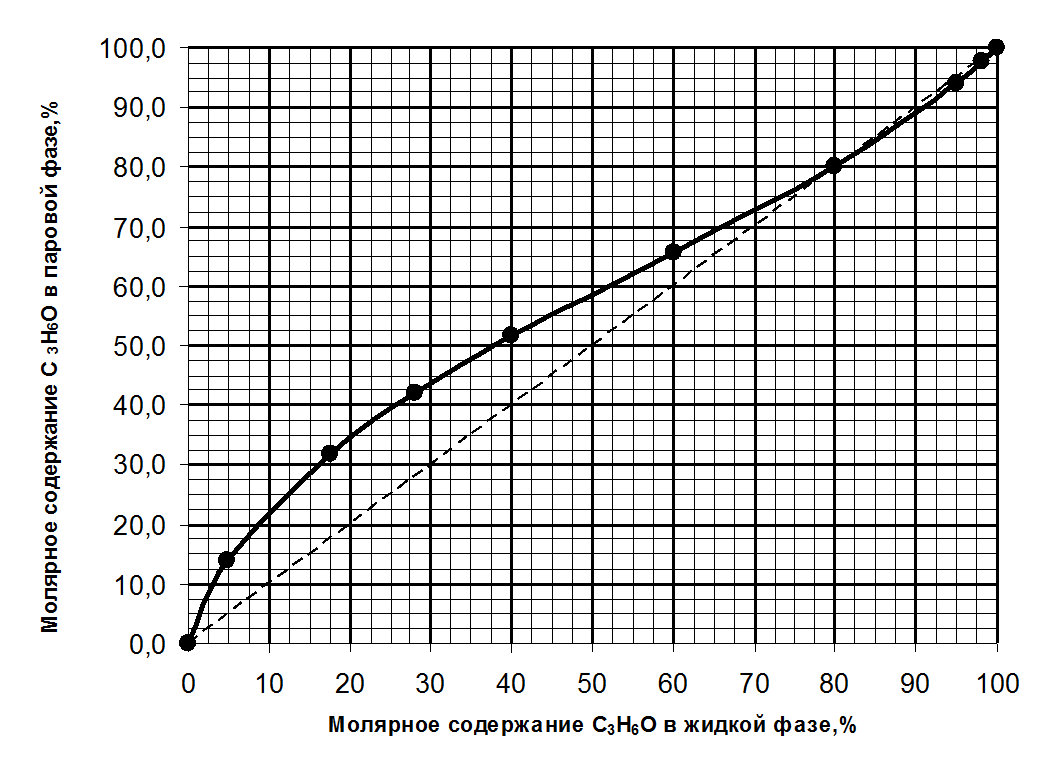
1. постройте график зависимости состава пара от состава жидкой фазы при постоянном давлении.
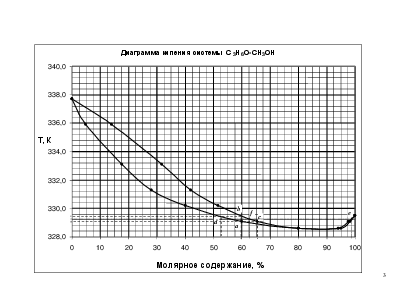
2. постройте диаграмму кипения системы А – В.
3. определить температуру кипения системы с молярной долей a % вещества А. Каков состав первого пузырька пара над этой системой; при какой температуре закончиться кипение системы; каков состав последней капли жидкой фазы?
4. определите состав пара, находящегося в равновесии с жидкой фазой, кипящей при температуре Т1 .
5. при помощи какого эксперимента можно установить состав жидкой бинарной системы, если она начнет кипеть при температуре Т1 при наличии диаграммы кипения системы.
6. какой компонент и в каком количестве может быть выделен из системы, состоящей из b кг вещества А и с кг вещества В.
7. какого компонента и какое количество необходимо добавить к указанной в п. 6 смеси, чтобы получилась азеотропная система.
8. какое количество вещества А будет в парах и в жидкой фазе, если 2 кг смеси с молярным содержанием a % вещества А нагреть до температуры Т1.
9. Определить вариантность системы в азеотропной точке.
|
№ варианта |
Система |
Р*10-4, Па |
Молярная доля А,% |
Т, К |
|
|
x - жидкая фаза |
у - пар |
||||
|
13 |
A - С3Н6О B - СН3ОН |
10,133 |
0,00 |
0,0 |
337,7 |
|
4,8 |
14,0 |
335,9 |
|||
|
17,6 |
31,7 |
333,1 |
|||
|
28,0 |
42,0 |
331,3 |
|||
|
40,0 |
51,6 |
330,2 |
|||
|
60,0 |
65,6 |
329,1 |
|||
|
80,0 |
80,0 |
328,6 |
|||
|
95,0 |
94,0 |
328,6 |
|||
|
98,2 |
97,6 |
329,1 |
|||
|
100,0 |
100,0 |
329,5 |
|||
[1], стр. 302
|
№ варианта |
T1 |
a |
b |
c |
|
13 |
329,25 |
60 |
73 |
27 |
1. Зависимость состава пара от состава жидкой фазы при постоянном давлении для системы С3Н6О – СН3ОН
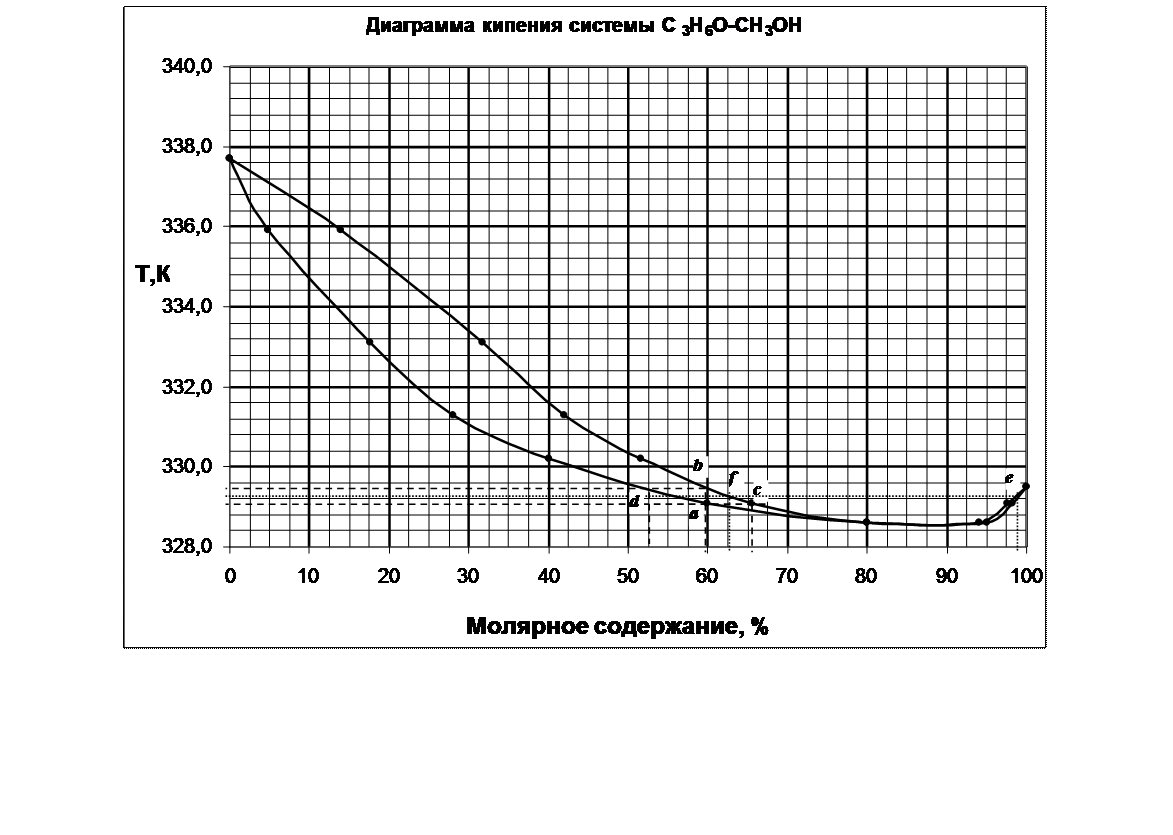
3. Определение температуры кипения системы с молярной долей 60 % С3Н6О.
Для определения температуры кипения системы необходимо провести перпендикуляр от оси Х, соответствующий содержанию в системе 60% С3Н6О. Пересечение перпендикуляра с кривой состава кипящей жидкости (нижней кривой диаграммы) показывает точку начала кипения системы – a, соответствующей температуре 329,1 К. Вплоть до 329,1 К система жидкая, гомогенная. При 329,1 К начинается кипение системы, состоящей из 60% С3Н6О и 40% СН3ОН. Для определения состава паровой фазы необходимо провести изотерму через точку а. Пересечение изотермы с кривой насыщенного пара показывает состав пара (точка с) – 66% С2Н6О и 34% СН3ОН. (Это будет состав первого пузырька пара над системой). Состав пара богаче С2Н6О, чем жидкость. Следовательно, жидкая фаза обедняется С3Н6О и ее состав меняется по линии ad. Состав пара меняется по линии cb. В точке b (при Т≈329,5)вся жидкая фаза превратиться в пар (отсюда, 329,5 – температура конца кипения). Состав пара сравняется с исходной жидкостью (60% С3Н6О). Состав последней капли жидкой фазы определяется по точке d – примерно 53 % С3Н6О и 47% СН3ОН.
4. Определение состава пара, находящегося в равновесии с жидкой фазой, кипящей при температуре 329,25 К.
Проводим изотерму Т=345 К, ее пересечение с кривой состава паровой фазы дает 2 точки – fиe. По ним определяем состав парообразной фазы. Соответственно 63% С3Н6О и 37% СН3ОН (слева от азеотропной точки) и 98% С3Н6О и 2% СН3ОН (справа от азеотропной точки).
5. При помощи какого эксперимента можно установить состав жидкой бинарной системы, если она начнет кипеть при температуре Т1 при наличии диаграммы кипения системы.
К исходной смеси необходимо добавить какой-нибудь из компонентов, например компонент А и снова измерить температуру кипения. Если Ткип уменьшиться по сравнению с Т1, значит система содержала недостаток А по сравнению с азеотропной смесью и ее состав определяем по левой части диаграммы (ок. 63% С3Н6О), в противном случае – содержала недостаток В и состав определяется по правой части диаграммы (98% С3Н6О).
6. Какой компонент и в каком количестве может быть выделен из системы, состоящей из 73 кг С3Н6О и 27 кг СН3ОН.
![]()
![]()
∑n = 1,09 + 0,84 = 1,93 кмоль
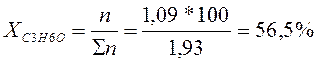
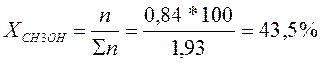
Так как заданный состав находиться слева от азеотропной точки, то выделить ректификацией в чистом виде можно только СН3ОН. Весь С3Н6О (1,09 кмоль) перейдет в азеотропную смесь с молярным содержанием 80%. (Азеотропная точка определяется по графику на пересечении линий жидкого и твердого состояния). Остальные 20% в азеотропном растворе составит СН3ОН.
Определим количество СН3ОН, перешедшего в азеотроп:
1,09 кмоль - 80%
x - 20%
![]()
Тогда в чистом виде можно выделить 0,84 – 0,27 = 0,57 кмоль или 0,57*32 = 18,2 кг СН3ОН.
7. Какого компонента и какое количество необходимо добавить к указанной в п. 6 смеси, чтобы получилась азеотропная система.
В п.6 система состоит из 56,5% С3Н6О и 43,5% СН3ОН. Азеотроп состоит из 80% С3Н6О и 20% СН3ОН. Метанол в системе находится в недостатке, относительно азеотропа, следовательно, к системе необходимо добавлять С3Н6О, чтобы получить из исходной системы азеотропную.
Число моль СН3ОН в азеотропе – 0,84 кмоль, что составляет 20%. Тогда пропорцией найдем количество С3Н6О в азеотропе.
![]()
Тогда количество бензола, которое необходимо добавить к исходной системе 3,36 – 1,09 = 2,27 кмоль или 2,27*58 = 131,6 кг
8. Какое количество вещества С3Н6О будет в парах и в жидкой фазе, если 2 кг смеси с молярным содержанием 60% С3Н6О нагреть до температуры 329,25 К.
Сначала определим количество молей вещества, которое содержится в системе массой 2 кг. Для этого вычислим среднюю молекулярную массу: Мср = 58*0,6 + 32*0,4 = 47,6.
В 2
кг содержится 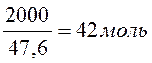 С3Н6О
и метанола.
С3Н6О
и метанола.
По диаграмме определяем молярный состав жидкой и парообразной фаз системы при Т=329,25 К при содержании в исходной жидкости 60% С3Н6О – 56% С3Н6О в жидкой и 63% С3Н6О - в парообразной.
По правилу рычага определяем количество С2Н6О:
![]()
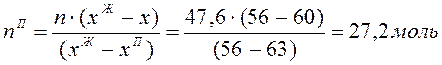
![]()
Тогда ![]()
![]()
9. Определить вариантность системы в азеотропной точке.
С = 2 – 2 + 1 – 1 = 0
Вариантность в азеотропной точки равна 0, т.е. инвариантна.
Литература:
[1] «Сборник примеров и задач по физической химии», Киселева Е.В., Каретников Г.С., изд. 4, 1976 г., 381 стр.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.