















Количественное определение.
Комплексонометрический (трилонометрический метод) с индикатором кислотным хром темно-синим (эриохром черный Т) в среде аммиачного буферного раствора.
Индикатор реагирует с Са2+ в щелочной среде с образованием вишнево-красного комплекса:
![]() H2Ind + Са2+ CaInd + 2 H+
H2Ind + Са2+ CaInd + 2 H+
При титровании трилоном Б в эквивалентной точке происходит переход окраски раствора в сине-фиолетовый цвет:
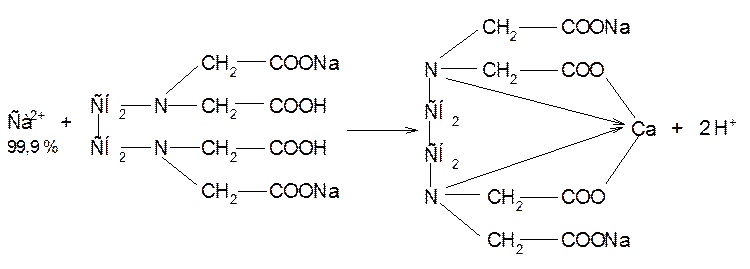
Аммиачный буферный раствор связывает ионы водорода, выделяющиеся в процессе реакции, смещая равновесие в сторону образования комплекса трилона Б с кальцием. В точке эквивалентности (совпадает с точкой окончания титрования) раствор приобретает окраску свободного индикатора.
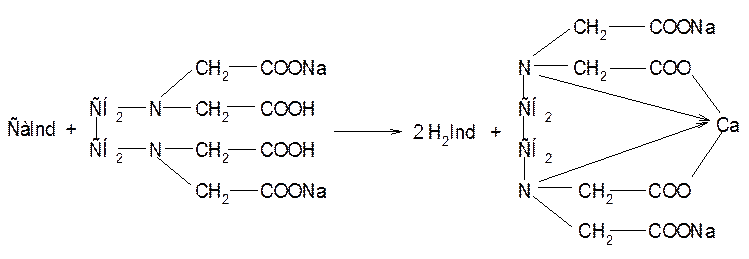
Возможны и другие методы количественного определения кальция хлорида: фотометрический, флуорометрический, аргентометрический, рефрактометрический.
Хранение. В хорошо укупоренных стеклянных банках с пробками, залитыми парафином. Крайняя гигроскопичность лекарственного средства и его способность расплываться под влиянием влаги делают состав кальция хлорида непостоянным, что может привести к неточности дозировки при приготовлении лекарств. Учитывая это, в аптеках готовят 50 % раствор кальция хлорида и используют этот концентрат при изготовлении лекарственных форм.
Применение.
1. При недостаточной функции паращитовидных желез, сопровождающейся тетанией или спазмофилией.
2. При аллергических заболеваниях и аллергических осложнениях, связанных с приемом лекарств.
3. Как кровоостанавливающее средство при легочных, желудочно-кишечных, носовых, маточных кровотечениях.
4. В хирургической практике иногда вводят перед оперативным вмешательством для повышения свертываемости крови
5. Как противоядие при отравлении солями магния.
Внутрь СаСl2 назначают столовыми ложками (десертными, чайными) 5 - 10 % раствора 2 – 3 раза в день после еды.
Внутривенно медленно по 5 – 10 – 15 мл 10 % раствора. При внутривенном введении СаСl2 появляется ощущение жара, сначала в полости рта, а затем по всему телу.
Растворы СаСl2 нельзя вводить подкожно или внутримышечно, так как они вызывают сильное раздражение и некроз тканей.
Кальция сульфат жженый – Calcii sulfas ustus
CaSO4 * 1/2 H2O
В природе широко распространен гипс – дигидрат кальция сульфата CaSO4 * 2 H2O.
При нагревании до 130 – 150оС он теряет часть своей кристаллизационной воды и превращается в полугидрат CaSO4 * 1/2 H2O, который и применяется в медицинской практике.
При температуре 150 оС и выше – теряет всю кристаллизационную воду и становится непригодным для применения.
Характеристика лекарственного средства (см. табл. 4).
Для кальция сульфата жженого ФС предусматривает испытание на затвердевание. Смесь 10 частей гипса и 5 частей воды должна затвердевать в белую твердую массу и ранее, чем через 4 минуты и не позднее, чем через 10 минут.
Хранение. Гипс хранят в сухом прохладном месте в хорошо укупоренных стеклянных и жестяных банках.
Применение. В хирургической и стоматологической практике.
Препараты магния
Оксид магния – Magnesii oxydum
MgO
Мелкий легкий белый порошок. Практически нерасторим в воде, растворим в разбавленной хлористоводородной кислоте. Применяется в качестве антацидного средства.
Получение препаратов магния
MgO
1. Обработка природных рассолов известковым молоком (гидроксид кальция) с последующей термической обработкой (при 500оС):
![]()
![]() MgCl2 + Ca(OH)2 Mg(OH)2 + CaCl2
MgCl2 + Ca(OH)2 Mg(OH)2 + CaCl2
![]() Mg(OH)2 toC MgO + H2O
Mg(OH)2 toC MgO + H2O
2. Обработка хлорида магния нагретым водяным паром:
![]() MgCl2 + H2O MgO + 2 HCl
MgCl2 + H2O MgO + 2 HCl
3. Путем термической обработки основного карбоната магния (t = 900 – 1000oC)
![]() 2 MgCO3 *
Mg(OH)2 * 3 H2O toC 4 MgO + 2 CO2
+ 8 H2O
2 MgCO3 *
Mg(OH)2 * 3 H2O toC 4 MgO + 2 CO2
+ 8 H2O
MgSO4 * 7 H2O
1. Путем нагревания магнезита MgCO3, обрабатывая его серной кислотой:
![]() MgCO3
+ H2SO4 toC MgSO4 + H2O
+ CO2
MgCO3
+ H2SO4 toC MgSO4 + H2O
+ CO2
Полученный раствор концентрируют упариванием до кристаллизации, при этом получается MgSO4 * 7 H2O.
Магния сульфат – Magnesii sulfas
MgSO4 * 7 H2O
Бесцветные призматические кристаллы, выветривающиеся на воздухе. Растворим в воде, нерастворим в спирте.
При приеме внутрь оказывает слабительное действие, при парентеральном применении – успокаивающее действие на ЦНС (в больших дозах может оказать курареподобный эффект).
Антагонистами иона магния являются ионы кальция. Соли кальция используют как антидоты при передозировке магния сульфата.
Подлинность препаратов магния определяется реакциями на ион магния и соответствующие анионы соли (см. табл. 4).
Нерастворимые в воде лекарственные средства (оксид магния
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.