10. Охарактеризувати вплив концентрації електролітів, рН середовища, температури на зміну величини електрокінетичного потенціалу.
Величина електролітичного потенціалу може змінюватись під впливом зовнішньої дії (введення в систему електролітів, зміна рН, концентрація золю, температура). Розподіл іонів ПЕШ є функцією концентрації електролітів в об’ємі дисперсійного середовища.
Щодо кожного золю електроліти можна поділити на індиферентні та неіндиферентні. В індиферентних відсутній іон, який міг би специфічно адсорбуватися на твердій поверхні колоїдних частинок, а неіндиферентні містять такі іони.
Із уведенням індиферентного електроліту загальний потенціал колоїдної частинки не змінюється, проте ζ-потенціал знижується за рахунок стиснення ПЕШ. Якщо у систему вводиться електроліт, один із іонів якого має заряд, однаковий із проти іоном, то дифузійний шар стискається доти, поки не стане рівнем адсорбційному. Внаслідок цього ζ-потенціал наближається до нуля. Колоїдна система перейде в ізоелектричний стан.
Якщо ж вводиться електроліт, який не містить спільних іонів з електролітом-стабілізатором, то буде проходити обмін проти іонів на еквівалентну кількість однакових за знаком заряду іонів введеного електроліту. У разі обміну одновалентних іонів співвідношення цих іонів у будь-якій точці ПЕШ буде таким самим, як і в глибині розчину. Якщо валентність проти іонів не однакова, то рівновага збільшується в бік іона з вищою валентністю, а ζ-потенціал знижується швидше.
Зміна рН середовища особливо впливає на золі, у яких дисперсна фаза є аморфною речовиною (Fe(OH)3, Al(OH)3, Sn(OH)4, Th(OH)4). У таких золів зі зміною рН дисперсійного середовища може відбуватися перезарядження частинок внаслідок зміни іонізації дисперсної фази.
За допомогою зміни рН середовища можна перезарядити колоїдні частинки. Повинно існувати таке значення рН, за якого ζ-потенціал дорівнює нулю, тобто система перебуває в ізоелектричному стані. При цьому кількість позитивних і негативних зарядів на поверхні твердої фази буде однакова.
Вплив температури. Незначні підвищення температури призводять до зростання електрокінетичного потенціалу системи. Це пояснюється тим, що з підвищенням температури збільшується кінетична енергія проти іонів. Частина проти іонів адсорбційного шару переходить у дифузійний шар, що збільшує його товщину. Отже, автоматично збільшується і ζ-потенціал за незмінного ϕ-потенціал. За подальшого підвищення температури починається десорбція потенціал визначальних іонів із твердої поверхні, що знижує ϕ-потенціал і зменшує ζ-потенціал.
11. Що таке стійкість дисперсних систем? Охарактеризувати різницю між агрегативною та седиментаційною стійкістю колоїдних систем за Пєсковим. Характеристика термодинамічних та кінетичних факторів стійкості.
Стійкість дисперсних систем – це сталість у часі їх стану та основних властивостей: дисперсності, рівномірного розподілу частинок дисперсної фази по всьому об’єму дисперсійного середовища, збереження характеру взаємодії між частинками тощо.
Пєсков у 1920 р. запропонував поділити стійкість дисперсних систем на агрегативну та седиментаційну.
Агрегативна стійкість – це здатність системи зберігати свій ступінь дисперсності, тобто не змінювати розподілу частинок за розмірами під впливом зовнішніх факторів.
Седиментаційна – це здатність системи зберігати рівномірний розподіл частинок в об’ємі дисперсійного середовища. Основними умовами цієї стійкості є висока дисперсність та участь частинок дисперсної фази у броунівському русі.
Стабільність систем зумовлюють фактори стійкості – термодинамічні та кінетичні.
До термодинамічних належать:
1) Електростатичний – сприяє утворенню електростатичних сил відштовхування, які зростають зі збільшенням ϕ-потенціалу, особливо ζ-потенціалу;
2) Адсорбційно-сольватний – призводить до зменшення між фазного поверхневого натягу за взаємодії частинок дисперсної фази з середовищем;
3) Ентропійний – є доповненням до перших двох факторів і діє у високодисперсних системах, частинки дисперсної фази яких беруть участь у броунівському русі.
До кінетичних факторів стійкості, що знижують швидкість агрегації частинок дисперсної фази, належать:
1) Структурно-механічний – пов'язаний з утворенням на поверхні частинок захисних шарів, що мають пружність і механічну міцність, руйнування яких потребує затрат енергії та часу;
2) Гідродинамічний – знижує швидкість агрегації внаслідок зміни в’язкості середовища, густини дисперсної фази та дисперсійного середовища.
12. Характеристика теорії стійкості та коагуляції ДЛФО. Правило Шульце-Гарді.
Коагуляція – це процес злипання колоїдних частинок дисперсної фази під впливом молекулярних сил притягання через втрату агрегативної стійкості.
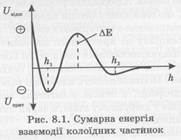 Сучасна теорія ДЛФО (розроблена у
1937-1941 р. ученими Дерягіним, Ландау, Фервеєм та Овербеком) стверджує, що між
колоїдними частинками за їх зближення виникає розклинювальний тиск внаслідок
дії електростатичних сил відштовхування та ван-дер-ваальсових сил притягання.
Оскільки енергія сил відштовхування зменшується з відстанню між частинками за
експоненційним законом, а енергія притягання змінюється обернено пропорційно
квадрату відстані між ними, то сумарну енергію системи одержують додаванням цих
енергій:
Сучасна теорія ДЛФО (розроблена у
1937-1941 р. ученими Дерягіним, Ландау, Фервеєм та Овербеком) стверджує, що між
колоїдними частинками за їх зближення виникає розклинювальний тиск внаслідок
дії електростатичних сил відштовхування та ван-дер-ваальсових сил притягання.
Оскільки енергія сил відштовхування зменшується з відстанню між частинками за
експоненційним законом, а енергія притягання змінюється обернено пропорційно
квадрату відстані між ними, то сумарну енергію системи одержують додаванням цих
енергій:
![]()
де В – коефіцієнт сил відштовхування, який залежить від значення електричних потенціалів ПЕШ. Властивостей середовища і температури; χ – величина, обернена товщині іонної атмосфери; h – відстань між частинками; А – стала молекулярних сил притягання.
Правило Шульце-Гарді: коагуляцію золю спричиняє той іон введеного електроліту, який має заряд, протилежний заряду колоїдной частинки, а коагулюючи дія тим сильніша, чим вищий заряд іона-коагулятора.
Мінімальне значення концентрації електроліту, що спричиняє коагуляцію золю, називають порогом коагуляції (Ск), а величину, обернено пропорційну порогу коагуляції, - коагулювальною здатністю (Vк). Коагулювальна здатність показує, скільки об’ємів золю може скоагулювати один моль іона-коагулятора.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.