3H2O 3CO2
Кількісно гідроліз у розбавлених розчинах характеризується константою гідролізу. Наприклад, гідроліз NaCN:
NaCN + H2O « NaOH + HCN; CN-+ Н2О « HCN + OH-.
Це – оборотний процес, тому йому відповідає константа рівноваги
К
=![]() .
.
Для розбавлених розчинів [H2O]>>[HCN], тоді можна вважати, що [H2O]=const,
K.[H2O]= Kг
= ![]() =
= ![]() =
=
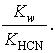
В цьому випадку константа гідролізу Кг = Kw/Kкис. Для солі слабкої основи і сильної кислоти Kr = Kw/Kосн, для солі слабкої основи і кислоти Kr = Kw/( Kкис. Kосн).
Ступінь гідролізу bг - відношення числа гідролізованних
молекул до загального числа молекул солі в розчині - зв¢язаний з константою гідролізу
співвідношеням br = ![]() , де См - молярна концентрація солі.
, де См - молярна концентрація солі.
Згідно з принципом ле Шательє розбавлення розчину солі і підвищення температури посилює гідроліз
Приклад 1. Визначити Kr і br для 0,1М розчину Na3PO4 (константи дисоціації H3PO4 відповідно дорівнюють K1 = 7.10-3; K2 = 6.10-8; K3 = 4.10-13).
Розв¢язок:
1. Кг1 - ? br1 - ?
PO43- + H2O = HPO42-+ OH- . Гідроліз по першому ступеню пов¢язаний з дисоціацією кислоти по третьому ступеню (HPO42- = H+ + PO43-) і K3. Тому Kr1 = Kw/K3 = 10-14 / (4.10-13) = 0,025;
br1 = ![]() =
=
![]() = 0,5 (50 %);
= 0,5 (50 %);
2. Кг2 - ? bг2 - ?
HPO42- + H2O = H2PO41- + OH-
Kr2 = Kw/K2 = 10-14 / (6.10-8) = 1,67.10-7;
br2 = ![]() =
=
![]() = 1,84.10-7
(0,184 %);
= 1,84.10-7
(0,184 %);
CМ(HPO42-) = 0,1. 0,5, тому що br1 = 50 % тобто 50 % Na3PO4 перетворилось у Na2HPO4.
Відповідь: Kr1 = 0,025, br1 = 50 %, Kr2 = 1,67.10-7, br2 = 0,184 %.
До рівноважних належить також система ²важкорозчинний електроліт - його насичений розчин², наприклад AgCl кр « Ag+ + Cl-.
Константа рівноваги K = [ Ag+] [Сl-] / [AgCl], де [AgCl кр] = const
Тоді K. [AgCl кр] = const = [Ag+] [Cl-] = ДР (AgCl).
В насиченому розчині важкорозчинного електроліту добуток концентрацій його іонів у ступенях стехіометричних коефіцієнтів при даній температурі є величина стала, яку називають добутком розчинності (ДР).
Приклад 2. Розрахувати розчинність AgI в воді і 0,01М розчину KI, якщо ДР (AgI) = 1.10-16.
Розв¢язок:
1. Розчинність AgI у воді - ?
Нехай х - розчинність AgI, моль/л. Згідно з рівнянням AgIкр « Ag+ +I-
[Ag+] = [I-] = х.
Звідки х2 = ДР (AgI) = 10-16; х = 10-8 моль/л..
2. Розчинність AgI у розчині КІ - ?
Якщо в розчин ввести 0,01 моль/л KI, концентрація I- буде 10-2 моль/л, тому що кількостю іонів І-, які утворились внаслідок дисоціації AgI, можна нехтувати; [Ag+] = 10-16/10-2 = 10-14, тобто розчинність AgI (однакова з [Ag+]) зменшується на шість порядків.
Відповідь: розчинність АgІ у воді дорівнює 10-8 моль/л, у розчині КІ - 10-14 моль/л.
Питання і задачі
1. Що називається гідролізом солей?
2. Чим кількісно характеризується гідроліз?
3. Написати реакції гідролізу Al2(SO4 )3 ; Na2SO 4; NH4Cl; Fe2S 3. Визначити pH розчинів.
4. Чому не існують розчини солей СuCO3, Al2(SO3)3, (NH4)2S ?
5. Чим пояснити слабко кисле середовище у розчинах солей, утворених сильними кислотами і сильними основами ?
6. З яким ступенем дисоціації кислоти Н2СО3 пов’язаний гідроліз солі К2СО3?
7. З яким ступенем дисоціації кислоти Н2SО3 пов’язаний гідроліз солі КHSО3?
8. Розрахувати константу і ступінь гідролізу 0,1 н. розчину NH4Cl (Kд(NH4OH) = 1,8.10 –5).
9. Що називається добутком розчинності?
10. Розчинність AgCl у воді дорівнює 10-5 моль/л. Обчислити ДР(AgCl) . Як змінюється розчинність AgCl при додаванні 0,1 моля NaCl на 1 л розчину?
Рекомендована література:
1. Глинка Н.Л. Общая химия. - Л.: Химия, 1980 - 1989 г.г.
2. Глинка Н.Л. Задачи и упражнения по общей химии.- Л.: Химия, 1988.
3..Романцева З.Л., Лещинская Л.М., Суханова В.А. Сборник задач и упражнений по общей химии.- М.: Высшая школа, 1991.
4. Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. - Київ: Вища школа, 1991.
5. Мороз А.С., Ковальова А.Г. Фізична і колоїдна хімія.- Львів: Світ, 1994.
План 2000
Евгенія Георгієвна Камінська
Світлана Юріівна Кельїна
Частина 1
Ст. редактор
Технічний редактор
Рецензія
на “Методичні вказівки для підготовки до лабораторних робіт з . курсу хіміі”
“Методичні вказівки для підготовки для лабораторних робіт з курсу хімії” розроблені згідно з основною програмою цієї дисціпліни. Вони містять основні теоретичні положення, які необхідні для виконання лабораторних робіт з курсу хімії. Крім того, у методичних вказівках розібрані основні методи розв’язку задач з відповідних тем, а також запропоновані питання і задачи для самостійної підготовки і самоконтролю знань. Вказівки призначені для студентів всіх спеціальностей і є необхідними при підготовці до лабораторних робіт і самостійної роботи студентів.
Рецензент к.т.н., доцент Матвієнко В.М.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.